专题辅导:高一化学《氧化还原反应》常见错误分析思维导图

例题1、下列关于氧化还原反应中的有关说法中正确的是( )A、被氧化的物质是氧化剂B、置换反应一定是氧化还原反应C、电解质
树图思维导图提供 专题辅导:高一化学《氧化还原反应》常见错误分析 在线思维导图免费制作,点击“编辑”按钮,可对 专题辅导:高一化学《氧化还原反应》常见错误分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a1294e86710c197294d07fc118fbbd61
思维导图大纲
专题辅导:高一化学《氧化还原反应》常见错误分析思维导图模板大纲
例题1、下列关于氧化还原反应中的有关说法中正确的是( )
A、被氧化的物质是氧化剂
B、置换反应一定是氧化还原反应
C、电解质溶液导电过程发生氧化还原反应
D、元素由化合态转化为游离态时,该元素一定被还原
[错误解答]选B、D。
[错误原因]对电解质溶液导电实质不理解以及对元素化合态形式存在时的化合价的理解不够全面。
[正确解答]1)氧化还原反应过程中,氧化剂得到电子被还原,而还原剂失去电子被氧化;2)置换反应不仅有单质参加,而且有新单质生成,反应过程中一定有电子转移,因此一定是氧化还原反应;3)电解质导电过程,实质就是电解的过程,而电解反应一定是氧化还原反应;4)阳离子得到电子生成单质时,发生还原反应(被还原);而阴离子转化为单质,因失去电子而被氧化。本题正确选项为B、C。
例题2、下列四类反应:①置换反应,②复分解反应,③没有单质参加的化合反应,④没有单质生成的分解反应。其中一定不是氧化还原反应的是( )
A、只有② B、只有②③ C、②③④ D、①②③④
[错误解答]选C。
[错误原因]对四种基本反应类型和氧化还原反应关系的理解不够深入。
[正确解答]本题只有A选项正确。根据置换反应的概念和实质可以推知它一定是氧化还原反应。对于化合反应和分解反应,只要有单质参加或生成,则一定是氧化还原反应;而没有单质参加或生成的化合反应和分解反应,则有些是氧化还原反应,有些不是氧化还原反应。例如,这样的两个反应:Na2O2+SO2=Na2SO4、NH4NO3=N2O+2H2O,虽然没有单质参加或生成,但它们仍然属于氧化还原反应。
例题3、X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y
A、只有① B、只有②③ C、只有①④ D、①②③④
[错误解答]选B或C
[错误原因]思维不够慎密、全面,只把X、Y、Z当作金属或非金属一种情况考虑。
[正确解答]选D。由于置换反应既可有金属间的置换、又可在非金属之间置换,因此X、Y、Z既可以是金属、也可以是非金属。对于这两种情况,说法①②都可以是正确的;它们对应的离子,如果这些元素金属性(非金属)性越强,则对应的离子的氧化性(还原性)也越弱,因此③④的说法也可以是正确的。
例题4、铁屑溶于过量的盐酸后,再加入下列物质,会有三价铁生成的是( )
A、硫酸 B、氯水 C、硝酸锌 D、氯化钙
[错误解答]选B。Cl2有强氧化性,会把铁与盐酸反应生成的Fe2+氧化为Fe3+。
[错误原因]忽略酸性条件下NO3—具有强氧化性而漏选。
[正确解答]本题正确选项为B、C。对于B的分析同上。解答本题时还应该注意的是:题干中指明盐酸过量,因此反应后溶液呈酸性。再往溶液中添加硝酸锌时,由于溶液中存在H+,硝酸根离子将显强氧化性,可以将亚铁离子氧化,反应为:
4H++NO3—+2Fe2+=3Fe3+NO↑+2H2O
因此选项C也是正确的。(注意:在考虑离子共存问题时,一定不要忽视下列离子的氧化性(或在酸性条件下具有氧化性):NO3-、ClO-、MnO4-、Fe3+等。)
例题5、化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B——X+C,X是一种单质,由此可知X元素( )
A、一定是金属元素 B、一定是非金属元素
C、可能是金属元素,也可能是非金属元素 D、无法确定
[错误解答]选C或D。
[错误原因]对"归中型"氧化还原反应及元素性质的认识不够深入。
[正确解答]根据题意:1)A、B、C都是化合物;2)A、B均含X元素;3)反应生成单质X,可以推知该反应为"归中型"氧化还原反应。即化合物A、B中X元素的化合价"一高一低"(一个高于0价、一个低于0价),两者共同作用生成X单质(化合价为0)。由于金属元素在化合物中只呈现正价态,不可能有负价态,因此可以肯定X不是金属元素;只有非金属元素在化合物中才既可呈正价态,又可呈负价态,并在一定条件下可以发生归中反应。例如:2H2S+SO2=3S+2H2O,4NH3+6NO==5N2+6H2O,所以X应该是非金属,即该题的答案为B。
例题6、在氧化还原反应KClO3+6HCl=KCl+3Cl2+3H2O中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为___________
A、5:1 B、3:1 C、1:3 D、1:5
[错误解答]选B。由于反应过程中每个KClO3得到6个电子被还原为Cl—,而每2个HCl失去2个电子被氧化为Cl2。根据电子得失关系守恒关系,可知:氧化产物和还原产物的物质的量之比为3:1,选择B。
[错误原因]不明确该反应的实质,解题过程中违背同种元素发生氧化还原反应时化合价变化遵循"只靠近不交叉"的原则。
[正确解答]由于该反应属于"归中型"氧化还原反应,反应机理为:KClO3中Cl得到5个电子转化为Cl2(被还原),同样的HCl中的Cl失去一个电子转化为Cl2(被氧化),反应中氧化产物和还原产物均为Cl2,且氧化产物和还原产物的物质的量之比等于氧化剂得电子数和还原剂失去电子数之比,即5:1;选择A。
例题7、在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A、1/5 mol B、2/5 mol C、3/5mol D、11/5 mol
[错误解答]选B。从化学方程式可看出,当15mol CuSO4参加氧化还原反应时将生成6mol H3PO4,所以1mol CuSO4 氧化2/5 mol的P并生成2/5 mol H3PO4。
[错误原因]没有注意到H3PO4有一半是P自身氧化还原反应(歧化反应)生成的。
[正确解答]本题中的还原剂是P,而氧化剂是P和CuSO4。由于反应过程中Cu从+2降为+1,因此反应中共得到15mol的电子;而做还原剂的P在反应中从0升至+5价,因此1mol P得到5mol电子。因此15molCuSO4在反应中只能氧化3mol的P,即每摩尔硫酸铜能够氧化0.2mol的P。正确选项为A。
例题8、标准状况下,往100mL 0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A、0.224L B、0.336L C、0.448L D、0.672L
[错误解答]由于2Br- + Cl2=Br2 + 2Cl-,根据题意,有50%的Br-被氧化,即有0.02mol被氧化,因此通入的氯气的体积为0.224L。选A。
[错误原因]忽略离子还原性强弱。在氧化还原反应中,还原性(氧化性)越强的物质(或微粒)优先参与氧化还原反应。
[正确解答]由于Fe2+还原性比Br-强,当往FeBr2中通入氯气,发生的反应依次为:1)Cl2+2Fe2+=2Cl—+2Fe3+;2)Cl2+2Br—=2Cl—+Br2。因此溶液反应中反应的情况应该是:Fe2+被完全氧化并有50% Br— 被氧化。根据电子得失关系,Fe2+、Br—离子失去的电子总数(0.02mol+0.02mol=0.04mol)等于Cl2得到的电子总数。由于每个Cl2在反应中得到2个电子,因此Cl2的物质的量为0.02mol,其体积为0.448L。本题正确答案为C。(注:分析多种离子共存的溶液体系的电解问题时,也必须考虑离子反应次序——对于氧化性或还原性越强的离子,电解过程中一般优先放电。)
例题9、取17.4 g MnO2固体粉末与一定体积的浓盐酸(含溶质0.4mol)共热制取氯气(假设HCl挥发损失不计),下列叙述中正确的是( )
A、反应过程中MnO2作催化剂 B、盐酸未完全反应
C、参加反应的盐酸有一半被氧化 D、反应产生2.24L氯气(标况)
[错误解答]选C、D。根据该反应中量的关系:MnO2——4HCl可知,该反应中MnO2过量,因此HCl完全反应。又因该反应中只有一半的HCl作还原剂(另一半为起到酸的作用),因此参加反应的盐酸有一半被氧化(0.2mol),得到2.24L的氯气。
[错误原因]静态考虑反应问题,忽略盐酸浓度变化引起还原性变化的事实。
[正确解答]随反应的进行,盐酸的浓度逐渐减小,对应的还原性逐渐减弱,直至发生的氧化还原反应被停止。因此该反应过程中,虽然MnO2过量,盐酸也不可能完全反应,同样的,收集到的气体也不可能是2.24L。但是不论如何,参与反应的盐酸一定有一半被氧化(对应的量一定少于0.2mol)。因此正确选项为C。(注:许多物质的氧化(还原)性会受浓度变化的影响,并在一些具体的反应中表现出来。例如,浓硫酸具有氧化性,在加热的条件下与铜能够发生反应,随反应的进行,硫酸浓度变小,氧化性逐渐减弱,最终反应将停止;若参加反应的金属为Zn等活泼金属,则当浓度降低到一定程度(转化为稀硫酸)时,又会有H2产生。又如,浓硝酸具有强氧化性,与铜反应生成NO2,随反应进行,浓度减小,氧化性将有所减弱。当浓度减小到一定程度,反应产物变为NO。在解此类问题时,必须要打破常规,"动态"地考虑反应进行问题。这类问题也常在化学计算中出现。)
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
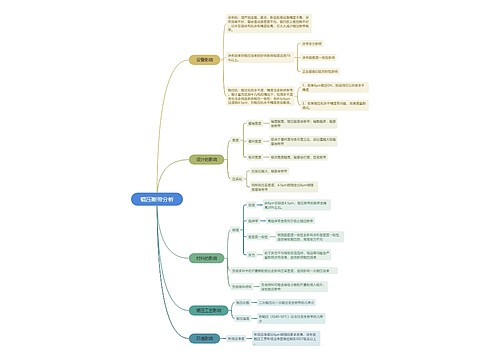

树图思维导图提供 辊压断带分析 在线思维导图免费制作,点击“编辑”按钮,可对 辊压断带分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:55fdf0827fa2a220b0b4047d75df5032










 上海工商
上海工商