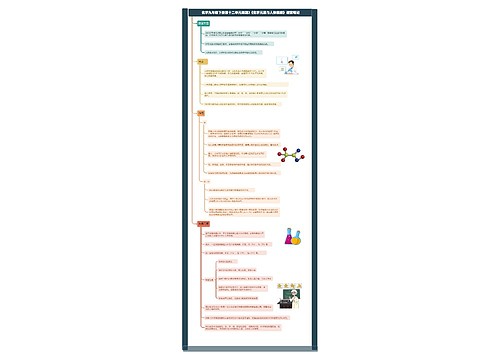
高二化学选修四知识点思维导图
只有高效的学习方法,才可以很快的掌握知识的重难点。有效的读书方式根据规律掌握方法,不要一来就死记硬背,先找规律,再记忆,然后再学习,就能很快的掌握知识。树图网高二频道为你整理了《高二化学选修四知识点》希望对你有帮助!
树图思维导图提供 高二化学选修四知识点 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学选修四知识点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5b926480f8163817448658ee13008d52
思维导图大纲
高二化学选修四知识点思维导图模板大纲
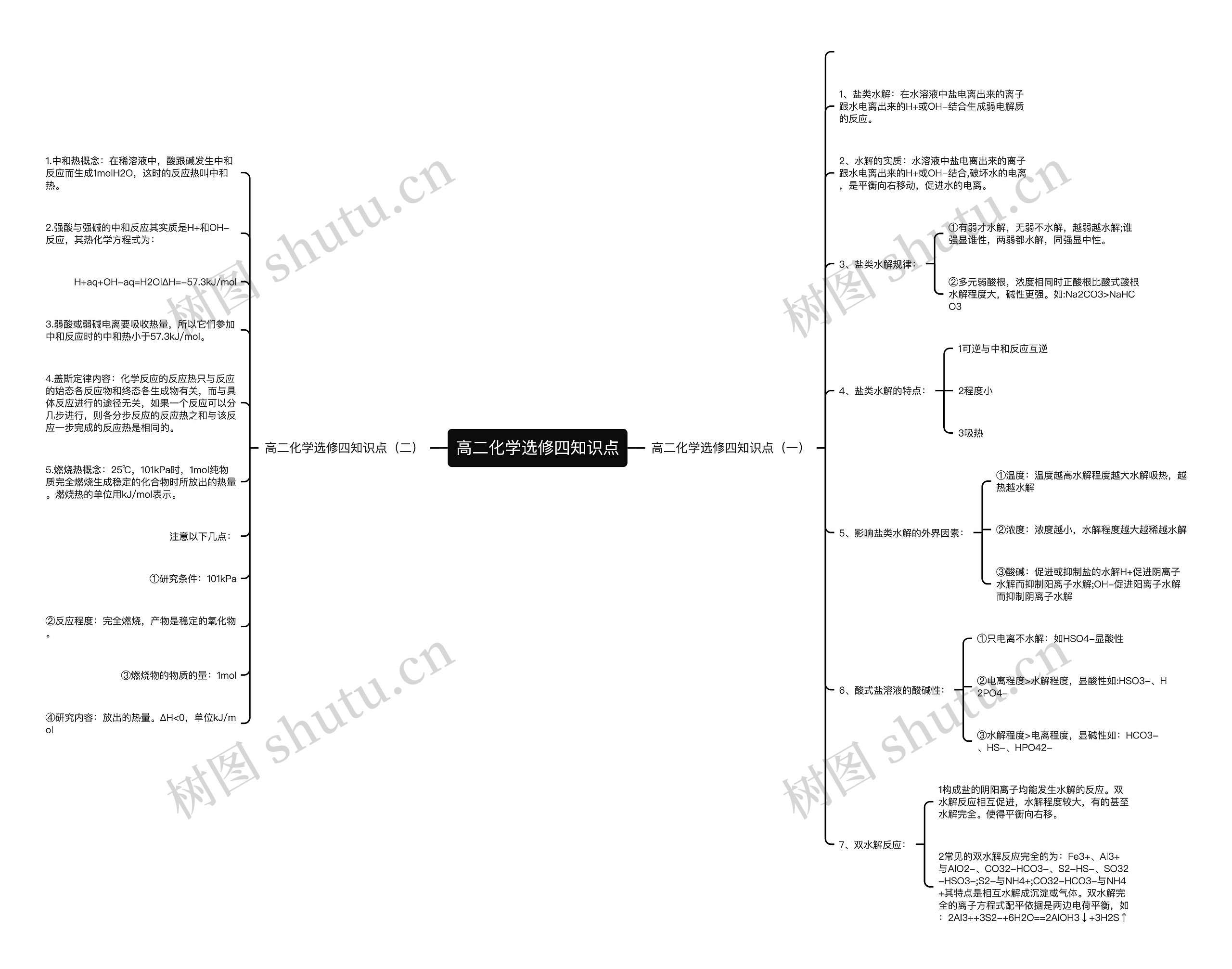
高二化学选修四知识点(一)
1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
3、盐类水解规律:
①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。如:Na2CO3>NaHCO3
4、盐类水解的特点:
1可逆与中和反应互逆
2程度小
3吸热
5、影响盐类水解的外界因素:
①温度:温度越高水解程度越大水解吸热,越热越水解
②浓度:浓度越小,水解程度越大越稀越水解
③酸碱:促进或抑制盐的水解H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解
6、酸式盐溶液的酸碱性:
①只电离不水解:如HSO4-显酸性
②电离程度>水解程度,显酸性如:HSO3-、H2PO4-
③水解程度>电离程度,显碱性如:HCO3-、HS-、HPO42-
7、双水解反应:
1构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。
2常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-HCO3-、S2-HS-、SO32-HSO3-;S2-与NH4+;CO32-HCO3-与NH4+其特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++3S2-+6H2O==2AlOH3↓+3H2S↑
高二化学选修四知识点(二)
1.中和热概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。
2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:
H+aq+OH-aq=H2OlΔH=-57.3kJ/mol
3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
4.盖斯定律内容:化学反应的反应热只与反应的始态各反应物和终态各生成物有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
5.燃烧热概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。
注意以下几点:
①研究条件:101kPa
②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1mol
④研究内容:放出的热量。ΔH<0,单位kJ/mol
相关思维导图模板

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826

树图思维导图提供 数智技术在工程设备管理中的应用 在线思维导图免费制作,点击“编辑”按钮,可对 数智技术在工程设备管理中的应用 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9a2de84ad9a9ceebc96385d71be9ebe








 上海工商
上海工商