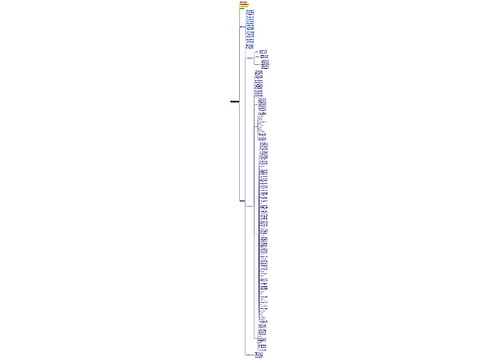
高二下学期化学重要知识点思维导图

高二是是成绩分化的分水岭,成绩两极分化严重,从高二开始,同学之间的差距开始逐渐拉开。高一成绩很好的同学可能高二成绩并不理想,而有些同学却能成为黑马。因此称之为分水岭并不为过。一旦被别人在这时候甩下,再想赶上可能就要费数倍的力气,因此我们必须重视这一年的蜕变。下面是树图网为大家带来的《高二下学期化学重要知识点》,希望可以帮到你!
树图思维导图提供 高二下学期化学重要知识点 在线思维导图免费制作,点击“编辑”按钮,可对 高二下学期化学重要知识点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:258f483623924b7a1ac5fc16e9fd3d56
思维导图大纲
高二下学期化学重要知识点思维导图模板大纲
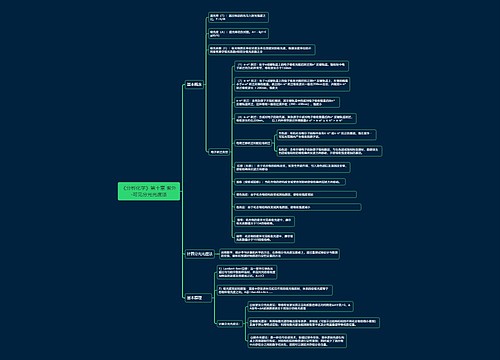
【篇一】
1、SO2能作漂白剂。SO2虽然能漂白一般的有机物,但不能漂白指示剂如石蕊试液。SO2使品红褪色是因为漂白作用,SO2使溴水、高锰酸钾褪色是因为还原性,SO2使含酚酞的NaOH溶液褪色是因为溶于不生成酸。
2、SO2与Cl2通入水中虽然都有漂白性,但将二者以等物质的量混合后再通入水中则会失去漂白性,
3、往某溶液中逐滴加入稀盐酸,出现浑浊的物质:
第一种可能为与Cl-生成难溶物。包括:①AgNO3
第二种可能为与H+反应生成难溶物。包括:
①可溶性硅酸盐SiO32-,离子方程式为:SiO32-+2H+=H2SiO3↓
②苯酚钠溶液加盐酸生成苯酚浑浊液。
③S2O32-离子方程式:S2O32-+2H+=S↓+SO2↑+H2O
④一些胶体如FeOH3先是由于FeOH3的胶粒带负电荷与加入的H+发生电荷中和使胶体凝聚,当然,若继续滴加盐酸至过量,该沉淀则会溶解。若加HI溶液,最终会氧化得到I2。
⑤AlO2-离子方程式:AlO2-+H++H2O==AlOH3当然,若继续滴加盐酸至过量,该沉淀则会溶解。
4、浓硫酸的作用:
①浓硫酸与Cu反应——强氧化性、酸性②实验室制取乙烯——催化性、脱水性
③实验室制取硝基苯——催化剂、吸水剂④酯化反应——催化剂、吸水剂
⑤蔗糖中倒入浓硫酸——脱水性、强氧化性、吸水性
⑥胆矾中加浓硫酸——吸水性
5、能发生银镜反应的有机物不一定是醛.可能是:
①醛;②甲酸;③甲酸盐;④甲酸酯;⑤葡萄糖;⑥麦芽糖均在碱性环境下进行
6、既能与酸又能与碱反应的物质
①显两性的物质:Al、Al2O3、AlOH3
②弱酸的铵盐:NH42CO3、NH42SO3、NH42S等。
③弱酸的酸式盐:NaHS、NaHCO3、NaHSO3等。
④氨基酸。
⑤若题目不指定强碱是NaOH,则用BaOH2,Na2CO3、Na2SO3也可以。
7、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2g、HCN。
8、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。
9、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2g。
10、可使湿润的红色石蕊试纸变蓝的气体:NH3。有漂白作用的气体:Cl2有水时和SO2,但两者同时使用时漂白效果减弱。检验Cl2常用淀粉碘化钾试纸,Cl2能使湿润的紫色石蕊试纸先变红后褪色。
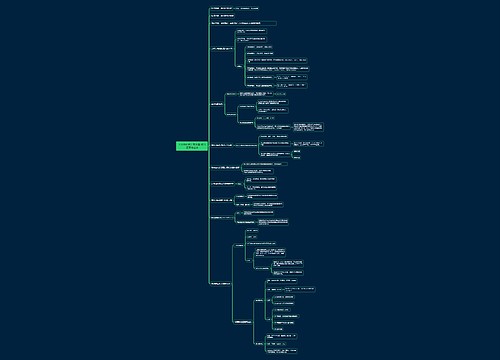
【篇二】
1、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
非氧化还原反应:原子守恒、电荷平衡、物料平衡用得多,氧化还原反应:电子守恒用得多
2、电子层结构相同的离子,核电荷数越多,离子半径越小;
3、体的熔点:原子晶体>离子晶体>分子晶体中学学到的原子晶体有:Si、SiC、SiO2=和金刚石。原子晶体的熔点的比较是以原子半径为依据的:金刚石>SiC>Si因为原子半径:Si>C>O.
4、分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
5、体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。
6、氧化性:MnO4->Cl2>Br2>Fe3+>I2>S=4+4价的S
例:I2+SO2+H2O=H2SO4+2HI
7、有Fe3+的溶液一般呈酸性。
8、能形成氢键的物质:H2O、NH3、HF、CH3CH2OH。
9、水乙醇溶液一样的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。
10、子是否共存:
1是否有沉淀生成、气体放出;
2是否有弱电解质生成;
3是否发生氧化还原反应;
4是否生成络离子[FeSCN2、FeSCN3、AgNH3+、[CuNH34]2+等];
5是否发生双水解。
相关思维导图模板

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826








 上海工商
上海工商