高二化学基本知识点归纳思维导图

只有高效的学习方法,才可以很快的掌握知识的重难点。有效的读书方式根据规律掌握方法,不要一来就死记硬背,先找规律,再记忆,然后再学习,就能很快的掌握知识。树图网高二频道为你整理了《高二化学基本知识点归纳》希望对你有帮助!
树图思维导图提供 高二化学基本知识点归纳 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学基本知识点归纳 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:9c458bf42d63336dfe4802ea4094087a
思维导图大纲
高二化学基本知识点归纳思维导图模板大纲
【篇一】
1、SO2能作漂白剂。SO2虽然能漂白一般的有机物,但不能漂白指示剂如石蕊试液。SO2使品红褪色是因为漂白作用,SO2使溴水、高锰酸钾褪色是因为还原性,SO2使含酚酞的NaOH溶液褪色是因为溶于不生成酸。
2、SO2与Cl2通入水中虽然都有漂白性,但将二者以等物质的量混合后再通入水中则会失去漂白性,
3、往某溶液中逐滴加入稀盐酸,出现浑浊的物质:
第一种可能为与Cl-生成难溶物。包括:①AgNO3
第二种可能为与H+反应生成难溶物。包括:
①可溶性硅酸盐SiO32-,离子方程式为:SiO32-+2H+=H2SiO3↓
②苯酚钠溶液加盐酸生成苯酚浑浊液。
③S2O32-离子方程式:S2O32-+2H+=S↓+SO2↑+H2O
④一些胶体如FeOH3先是由于FeOH3的胶粒带负电荷与加入的H+发生电荷中和使胶体凝聚,当然,若继续滴加盐酸至过量,该沉淀则会溶解。若加HI溶液,最终会氧化得到I2。
⑤AlO2-离子方程式:AlO2-+H++H2O==AlOH3当然,若继续滴加盐酸至过量,该沉淀则会溶解。
4、浓硫酸的作用:
①浓硫酸与Cu反应——强氧化性、酸性②实验室制取乙烯——催化性、脱水性
③实验室制取硝基苯——催化剂、吸水剂④酯化反应——催化剂、吸水剂
⑤蔗糖中倒入浓硫酸——脱水性、强氧化性、吸水性
⑥胆矾中加浓硫酸——吸水性
5、能发生银镜反应的有机物不一定是醛.可能是:
①醛;②甲酸;③甲酸盐;④甲酸酯;⑤葡萄糖;⑥麦芽糖均在碱性环境下进行
6、既能与酸又能与碱反应的物质
①显两性的物质:Al、Al2O3、AlOH3
②弱酸的铵盐:NH42CO3、NH42SO3、NH42S等。
③弱酸的酸式盐:NaHS、NaHCO3、NaHSO3等。
④氨基酸。
⑤若题目不指定强碱是NaOH,则用BaOH2,Na2CO3、Na2SO3也可以。
7、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2g、HCN。
8、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。
9、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2g。
10、可使湿润的红色石蕊试纸变蓝的气体:NH3。有漂白作用的气体:Cl2有水时和SO2,但两者同时使用时漂白效果减弱。检验Cl2常用淀粉碘化钾试纸,Cl2能使湿润的紫色石蕊试纸先变红后褪色。
【篇二】
1、化学反应的速率
1概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量均取正值来表示。
计算公式:
①单位:mol/L·s或mol/L·min
②B为溶液或气体,若B为固体或纯液体不计算速率。
③以上所表示的是平均速率,而不是瞬时速率。
④重要规律:
速率比=方程式系数比
变化量比=方程式系数比
2影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的主要因素。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率正催化剂
③浓度:增加C反应物的浓度,增大速率溶液或气体才有浓度可言
④压强:增大压强,增大速率适用于有气体参加的反应
⑤其它因素:如光射线、固体的表面积颗粒大小、反应物的状态溶剂、原电池等也会改变化学反应速率。
2、化学反应的限度——化学平衡
1在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态。
化学平衡的移动受到温度、反应物浓度、压强等因素的影响。催化剂只改变化学反应速率,对化学平衡无影响。
在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。通常把由反应物向生成物进行的反应叫做正反应。而由生成物向反应物进行的反应叫做逆反应。
在任何可逆反应中,正方应进行的同时,逆反应也在进行。可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质反应物和生成物的物质的量都不可能为0。
2化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。即v正=v逆≠0。
④定:达到平衡状态时,各组分的浓度保持不变,各组成成分的含量保持一定。
⑤变:当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
3判断化学平衡状态的标志:
①VA正方向=VA逆方向或nA消耗=nA生成不同方向同一物质比较
②各组分浓度保持不变或百分含量不变
③借助颜色不变判断有一种物质是有颜色的
④总物质的量或总体积或总压强或平均相对分子质量不变前提:反应前后气体的总物质的量不相等的反应适用,即如对于反应
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096
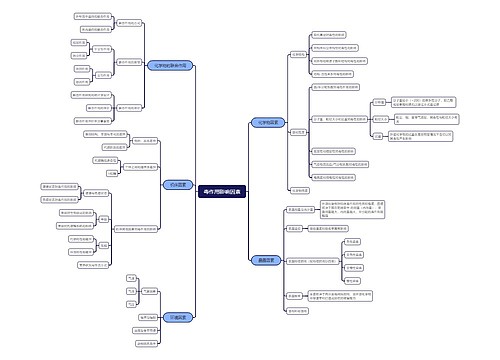

树图思维导图提供 毒作用影响因素 在线思维导图免费制作,点击“编辑”按钮,可对 毒作用影响因素 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:bc4e0796779ce5bc367d85524f09ab57








 上海工商
上海工商