高中化学离子共存知识点总结思维导图

离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。下面是壹壹高考网小编总结的高中化学离子共存知识点总结,供参考。
树图思维导图提供 高中化学离子共存知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学离子共存知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c5205427381579cecda8a56514a67fe1
思维导图大纲
高中化学离子共存知识点总结思维导图模板大纲
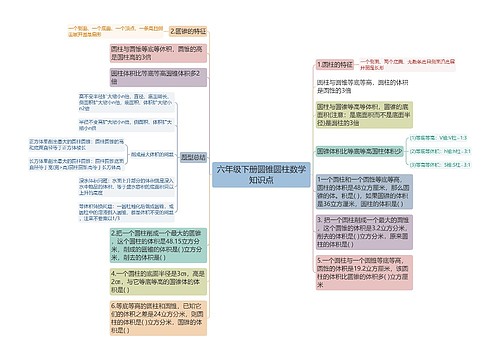
高中化学离子共存知识点总结:
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
点击查看:
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存;Fe3+与不能大量共存。
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826





 上海工商
上海工商