进口药品的注册要求思维导图

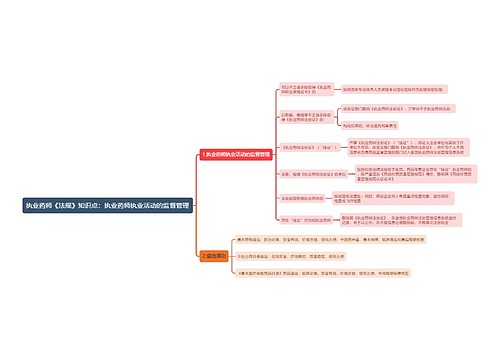
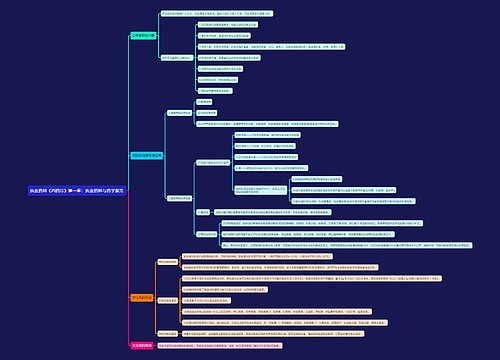
进口药品的注册要求: 第八十四条 申请进口的药品,应当获得境外制药厂商所在生产国家或者地区的上市许可;未在生产国家或者地区获得上市许可,但经国家食品药品监督管理局确认该药品安全、有效而且临床需要的,可以批准进口。
树图思维导图提供 进口药品的注册要求 在线思维导图免费制作,点击“编辑”按钮,可对 进口药品的注册要求 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:42d06bc9e5d7bc8fffc780b935f81f34
思维导图大纲
进口药品的注册要求思维导图模板大纲
进口药品的注册要求:
第八十四条 申请进口的药品,应当获得境外制药厂商所在生产国家或者地区的上市许可;未在生产国家或者地区获得上市许可,但经国家食品药品监督管理局确认该药品安全、有效而且临床需要的,可以批准进口。
申请进口的药品,其生产应当符合所在国家或者地区药品生产质量管理规范及中国《药品生产质量管理规范》的要求。
第八十五条 申请进口药品注册,应当填写《药品注册申请表》,报送有关资料和样品,提供相关证明文件,向国家食品药品监督管理局提出申请。
第八十六条 国家食品药品监督管理局对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书,并通知中国药品生物制品检定所组织对3个生产批号的样品进行注册检验;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
国家食品药品监督管理局可以组织对其研制和生产情况进行现场检查,并抽取样品。
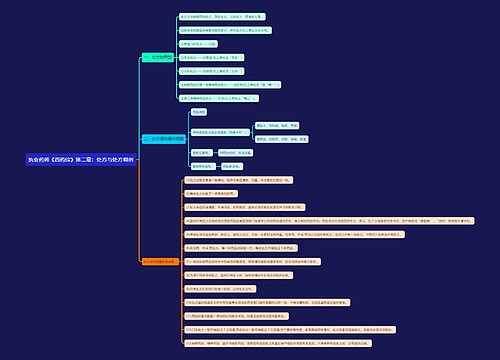
第八十七条 中国药品生物制品检定所收到资料和样品后,应当在5日内组织进行注册检验。
第八十八条 承担进口药品注册检验的药品检验所在收到资料、样品和有关标准物质后,应当在60日内完成注册检验并将药品注册检验报告报送中国药品生物制品检定所。
第八十九条 中国药品生物制品检定所接到药品注册检验报告和已经复核的进口药品标准后,应当在20日内组织专家进行技术审查,必要时可以根据审查意见进行再复核。
第九十条 中国药品生物制品检定所完成进口药品注册检验后,应当将复核的药品标准、药品注册检验报告和复核意见送交国家食品药品监督管理局药品审评中心,并抄送申请人。
第九十一条 国家食品药品监督管理局药品审评中心应当在规定的时间内组织药学、医学及其他技术人员对申报资料进行审评,必要时可以要求申请人补充资料,并说明理由。
第九十二条 国家食品药品监督管理局药品审评中心依据技术审评意见和样品检验结果等,形成综合意见,连同相关资料报送国家食品药品监督管理局,国家食品药品监督管理局依据综合意见,做出审批决定。符合规定的,发给《药物临床试验批件》;不符合规定的,发给《审批意见通知件》,并说明理由。
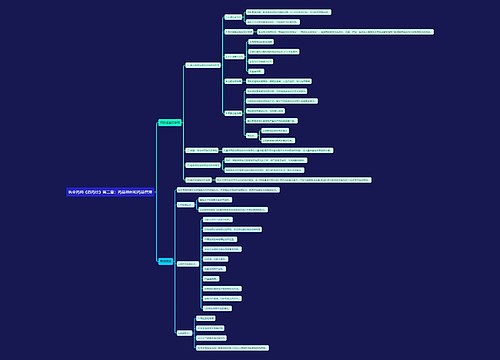
第九十三条 临床试验获得批准后,申请人应当按照本办法第三章及有关要求进行试验。
临床试验结束后,申请人应当填写《药品注册申请表》,按照规定报送临床试验资料及其他变更和补充的资料,并详细说明依据和理由,提供相关证明文件。
第九十四条 国家食品药品监督管理局药品审评中心应当在规定的时间内组织药学、医学及其他技术人员对报送的临床试验等资料进行全面审评,必要时可以要求申请人补充资料,并说明理由。
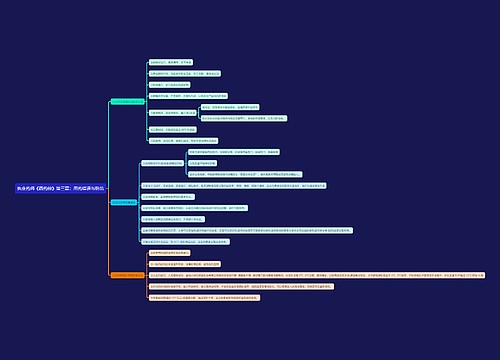
相关思维导图模板


树图思维导图提供 文创产品思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 文创产品思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e9a594f980a4df4a26055d02b91a9f41


树图思维导图提供 第六章 食品安全管理 在线思维导图免费制作,点击“编辑”按钮,可对 第六章 食品安全管理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b615e69c1c0fc8370834543c64f230de





 上海工商
上海工商