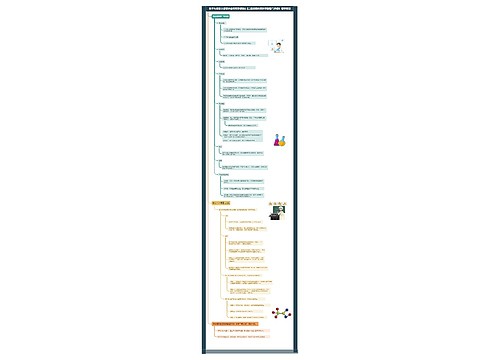
化学选修四微粒浓度思维导图
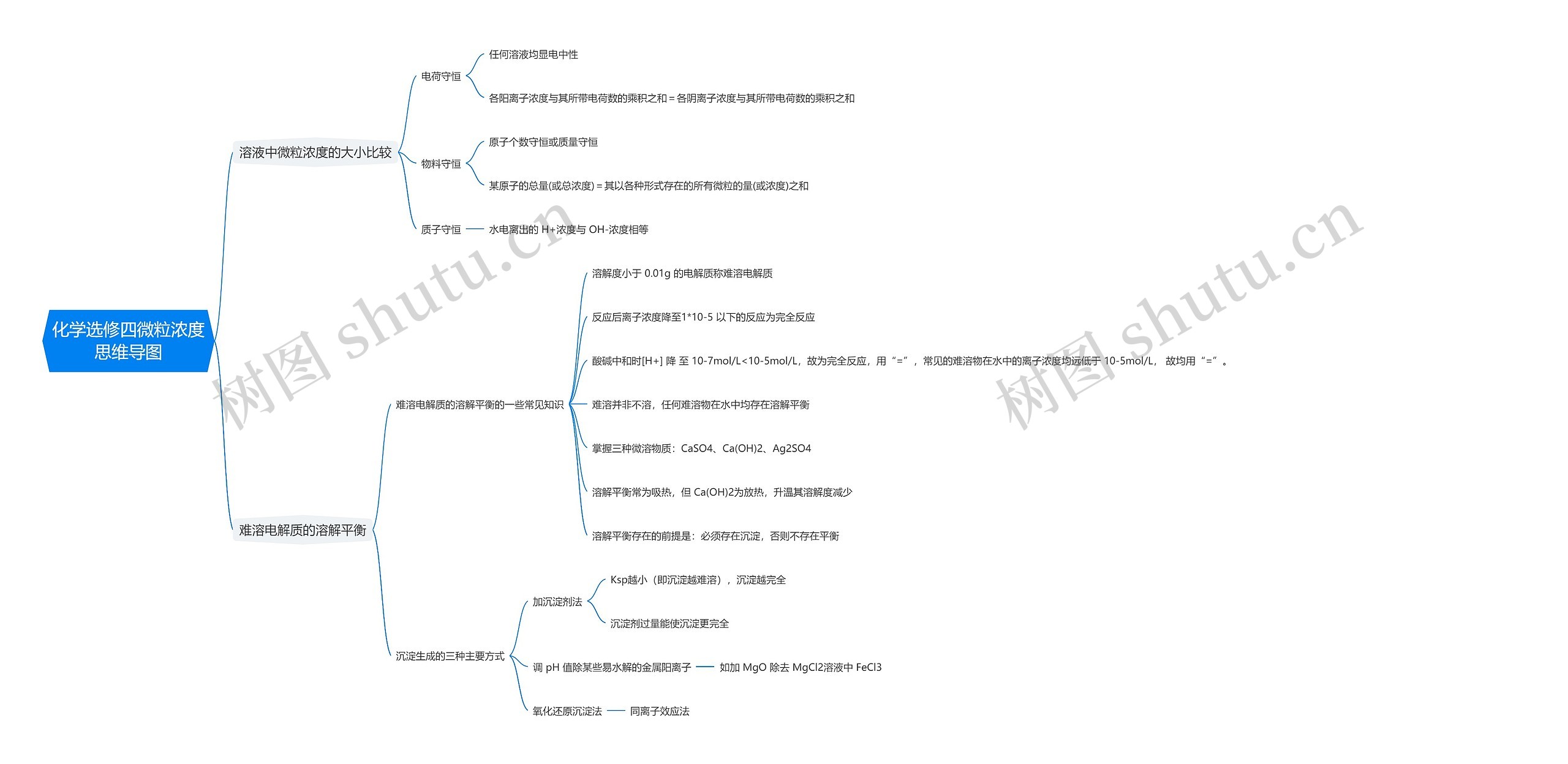
部编版高中化学选修四中有关微粒浓度的思维导图,包括溶液中微粒浓度的大小比较、难溶电解质的溶解平衡
树图思维导图提供 化学选修四微粒浓度思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 化学选修四微粒浓度思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f76bcfe1a23669c47aecd92b8586c8ba
思维导图大纲
化学选修四微粒浓度思维导图思维导图模板大纲
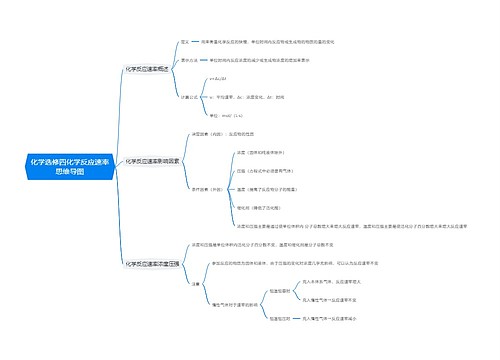
溶液中微粒浓度的大小比较
电荷守恒
任何溶液均显电中性
各阳离子浓度与其所带电荷数的乘积之和=各阴离子浓度与其所带电荷数的乘积之和
物料守恒
原子个数守恒或质量守恒
某原子的总量(或总浓度)=其以各种形式存在的所有微粒的量(或浓度)之和
质子守恒
水电离出的 H+浓度与 OH-浓度相等
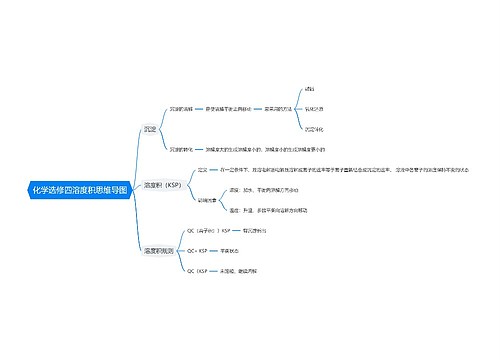
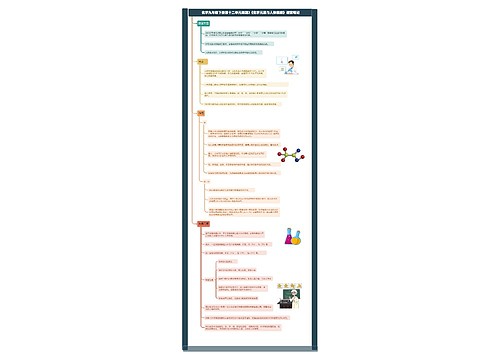
难溶电解质的溶解平衡
难溶电解质的溶解平衡的一些常见知识
溶解度小于 0.01g 的电解质称难溶电解质
反应后离子浓度降至1*10-5 以下的反应为完全反应
酸碱中和时[H+] 降 至 10-7mol/L<10-5mol/L,故为完全反应,用“=”,常见的难溶物在水中的离子浓度均远低于 10-5mol/L, 故均用“=”。
难溶并非不溶,任何难溶物在水中均存在溶解平衡
掌握三种微溶物质:CaSO4、Ca(OH)2、Ag2SO4
溶解平衡常为吸热,但 Ca(OH)2为放热,升温其溶解度减少
溶解平衡存在的前提是:必须存在沉淀,否则不存在平衡
沉淀生成的三种主要方式
加沉淀剂法
Ksp越小(即沉淀越难溶),沉淀越完全
沉淀剂过量能使沉淀更完全
调 pH 值除某些易水解的金属阳离子
如加 MgO 除去 MgCl2溶液中 FeCl3
氧化还原沉淀法
同离子效应法
相关思维导图模板
树图思维导图提供 化学选修四金属防护思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 化学选修四金属防护思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a79ddef9dc62e6cd0897d8493c979794
树图思维导图提供 化学选修四电化学腐蚀思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 化学选修四电化学腐蚀思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f410f2732ed516736c43871f83e98b3b








 上海工商
上海工商