分析化学酸碱滴定法基本原理的思维导图
本张思维导图关于酸碱滴定法基本原理的主要知识点
树图思维导图提供 分析化学酸碱滴定法基本原理的思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 分析化学酸碱滴定法基本原理的思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1f0864a48b873f20dbdf1004baa41ee8
思维导图大纲
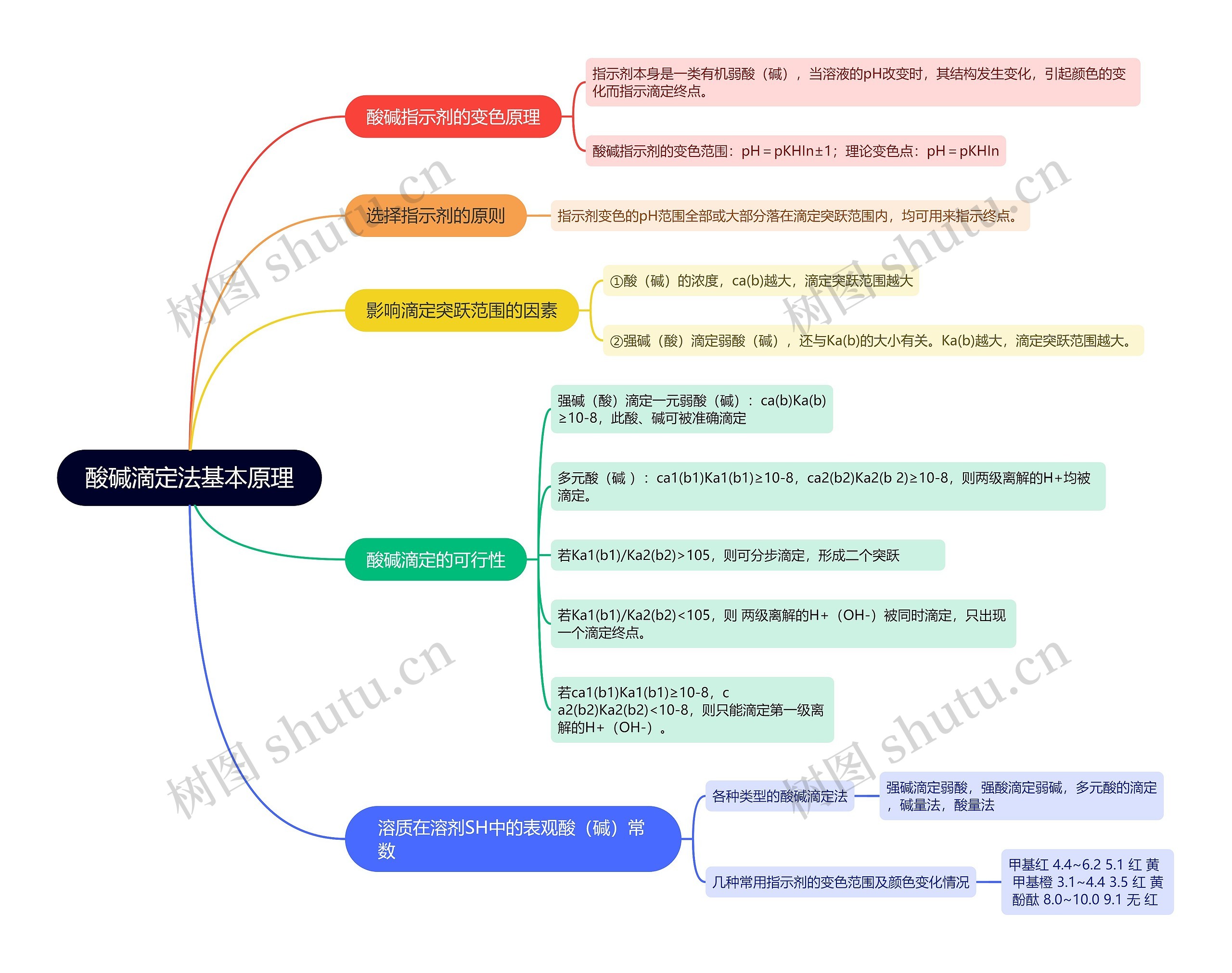
酸碱滴定法基本原理思维导图模板大纲
酸碱指示剂的变色原理
指示剂本身是一类有机弱酸(碱),当溶液的pH改变时,其结构发生变化,引起颜色的变化而指示滴定终点。
酸碱指示剂的变色范围:pH=pKHIn±1;理论变色点:pH=pKHIn
选择指示剂的原则
指示剂变色的pH范围全部或大部分落在滴定突跃范围内,均可用来指示终点。
影响滴定突跃范围的因素
①酸(碱)的浓度,ca(b)越大,滴定突跃范围越大
②强碱(酸)滴定弱酸(碱),还与Ka(b)的大小有关。Ka(b)越大,滴定突跃范围越大。
酸碱滴定的可行性
强碱(酸)滴定一元弱酸(碱):ca(b)Ka(b) ≥10-8,此酸、碱可被准确滴定
多元酸(碱 ):ca1(b1)Ka1(b1)≥10-8,ca2(b2)Ka2(b 2)≥10-8,则两级离解的H+均被滴定。
若Ka1(b1)/Ka2(b2)>105,则可分步滴定,形成二个突跃
若Ka1(b1)/Ka2(b2)<105,则 两级离解的H+(OH-)被同时滴定,只出现 一个滴定终点。
若ca1(b1)Ka1(b1)≥10-8,c a2(b2)Ka2(b2)<10-8,则只能滴定第一级离 解的H+(OH-)。
溶质在溶剂SH中的表观酸(碱)常数
各种类型的酸碱滴定法
强碱滴定弱酸,强酸滴定弱碱,多元酸的滴定,碱量法,酸量法
几种常用指示剂的变色范围及颜色变化情况
甲基红 4.4~6.2 5.1 红 黄 甲基橙 3.1~4.4 3.5 红 黄 酚酞 8.0~10.0 9.1 无 红
相关思维导图模板

树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商