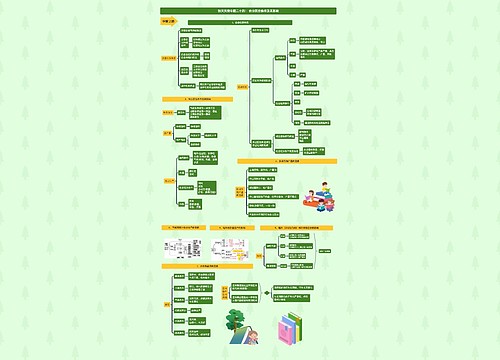
高一化学必修一必考知识点归纳思维导图

有很多学生在复习高一化学时,因为之前没对知识进行总结,导致复习时整体效率低下。
树图思维导图提供 高一化学必修一必考知识点归纳 在线思维导图免费制作,点击“编辑”按钮,可对 高一化学必修一必考知识点归纳 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:67be99c970fb6e499f84cc7c481e7e3a
思维导图大纲
高一化学必修一必考知识点归纳思维导图模板大纲
有很多学生在复习高一化学时,因为之前没对知识进行总结,导致复习时整体效率低下。为了方便大家学习借鉴,下面树图网精心准备了高一化学必修一必考知识点归纳内容,欢迎使用学习!
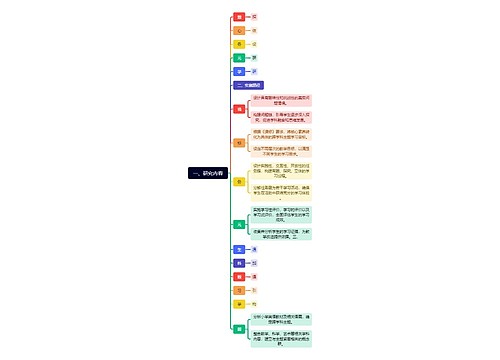
高一化学必修一必考知识点归纳
物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
3、氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
高一化学必修一化学方程式
1、金属钠投到硫酸铜溶液中的化学方程式:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH) 2↓+ Na2SO4 (先冒气泡再蓝色沉淀)
2、金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑
3、氢氧化钠方在空气中变质的化学方程式:
2NaOH+CO2=Na2CO3+H2O
Na2CO3+10H2O=Na2CO3·10H2O
4、金属钠放在空气的氧化:4Na+O2=2Na2O (银白色变暗)
5、金属钠在空气燃烧:2Na+O2=Na2O2 Δ (生成淡黄色粉末)
6、过氧化钠在空气中变质:
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
7、过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑
8、氧化钠在空气中变质:
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
9、氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O
10、氧化钠在空气中燃烧:2Na2O+O2=2Na2O2
11、氯气与铁的反应方程式:2Fe+3Cl2=2FeCl3 点燃 (红棕色的烟)
12、氯气与铜的反应方程式:Cu+Cl2=CuCl2 点燃 (棕黄色的烟)
13、氯气与氢气的反应方程式:Cl2+H2=2HCl 点燃 (苍白色火焰,生成白雾)
14、氯气与钠单质的反应方程式:2Na+Cl2=2NaCl 点燃 (淡黄色的烟)
15、工业制漂白:
2Cl2+2Ca(OH) 2=CaCl2+Ca(ClO) 2+2H2O (为Ca(OH) 2石灰乳)
16、氯气与水的方程式:Cl2+H2O=HCl+HClO
17、消毒 、处理多余的氯气、制84消毒液:
Cl2+2NaOH=NaClO+NaCl+H2O
18、次氯酸钠在空气中变质:
2NaClO+CO2+H2O=2HClO+Na2CO3
NaClO+CO2+H2O=HClO+NaHCO3
19、漂白在空气中变质:Ca(ClO) 2+CO2+H2O=CaCO3↓+2HClO
20、 次氯酸见光分解:2HClO=2HCl+O2↑ 光照
21、氯化铁通入沸水中制氢氧化铁胶体:
FeCl3+3H2O=Fe(OH) 3 (胶体)+3HCl Δ
22、碳酸钠与盐酸的反应方程式:
Na2CO3+2HCl(过)=2NaCl+CO2↑+H2O
Na2CO3+HCl(少)=NaHCO3+NaCl
23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
24、碳酸氢钠与碱反应方程式:
NaHCO3+NaOH=Na2CO3+H2O
NaHCO3+Ca(OH) 2=2H2O+Na2CO3+CaCO3↓
25、碳酸氢钠受热易分解:2NaHCO3=Na2CO3+CO2↑+H2O Δ
26、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O=2NaHCO3
27、浑浊石灰水变澄清:CO2+CaCO3+H2O=Ca(HCO3) 2
28、碳酸氢钙受热分解:Ca(HCO3) 2= CO2↑+CaCO3+H2O Δ
29、氢氧化亚铁在空气中变质:
4Fe(OH) 2+O2+2H2O=4Fe(OH) 3(由白色沉淀变成灰绿色再变成红褐色沉淀)
30、保存氯化亚铁溶液:
2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+
31、制造印刷线路板:
2FeCl3+Cu=2FeCl2+CuCl2 2Fe3++Cu=2Fe2++Cu2+
32、2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl-
33、Fe2O3+3CO = 2Fe+3CO2 高温
34、Ba2++SO42+=BaSO4↓ Ag++Cl-= AgCl↓
35、Zn+Cu2+= Zn2++Cu Zn+Fe2+= Zn2++Fe
36、溶洞的形成:
CO2+CaCO3+H2O=Ca(HCO3)2
Ca(HCO3)2=CO2↑+CaCO3+H2O Δ
37、NaHCO3+BaCl2 ?不反应 (一般情况下,强酸才能制弱酸)
38、工业上制取水煤气:C+H2O(g)=CO+H2 高温
39、自然界通过放电把氮气转化为一氧化氮:N2+O22NO 放电 (NO无色、难溶于水)
40、工业上制备氨气:N2+3H22NH3 高温、高压、催化剂
41、一氧化氮在常温下被氧化:2NO+O2=2NO2(NO2红棕色、有刺激性气味的有毒气体、易溶于水)
42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:
3NO2+H2O=2HNO3+NO
43、氨溶解于水:NH3+H2ONH3·H2O(一水合氨、弱碱性、能使酚酞溶液变红)
44、一水合氨的电离:NH3·H2ONH4++OH-
45、氨与盐酸的反应:NH3+HCl=NH4Cl
46、工业上制备硝酸需要的一氧化氮的方程式:4NH3+5O2=4NO+6H2O 高温 催化剂
47、碳酸氢铵受热分解:NH4HCO3=NH3↑+CO2↑+H2O Δ (密封保存在阴凉处、施肥时埋在土下)
48、氯化铵受热分解:NH4Cl=NH3↑+HCl↑ Δ
49、铵态氮肥不能与碱(如草木灰)混合施用:NH4++OH-=NH3↑+H2O Δ
50、实验室制氨气:2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O Δ(向上排空气法收集、湿润的红色石蕊试纸)
51、硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O 受热或见光 (应保存在棕色试剂瓶中、阴凉处)
52、铜与硝酸的反应:
Cu +4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O (遇浓硝酸生成二氧化氮)
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O (遇稀硝酸生成一氧化氮)
53、浓硝酸与木炭的反应:4HNO3(浓)+C=CO2↑+4NO2↑+2H2O Δ
54、硫单质铁的反应:Fe+S=FeS Δ
(硫单质的氧化性、S黄色或淡黄色固体,不溶水、微溶酒精、易溶CS2)
55、硫单质与氧气的反应:S+O2=SO2 点燃
(硫单质的还原性、SO2有刺激性气味的`有毒气体、易溶于水)
56、硫粉遇碱发生歧化反应:3S+6NaOH=2Na2S+Na2SO3+3H2O Δ
57、黑火药爆炸的化学方程式:S+2KNO3+3C=K2S+3CO2↑+N2↑
58、二氧化硫被氧气氧化:2SO2+O22SO3 催化剂 Δ
59、二氧化硫与硫化氢发生归中反应:SO2+2H2S=3S↓+2H2O (H2S臭鸡蛋气味)
60、浓硫酸与铜加热发生反应:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O Δ
61、浓硫酸与木炭加热发生反应:2H2SO4(浓)+C=2SO2↑+CO2↑+2H2O Δ
62、二氧化硫能使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3↓+H2O
63、二氧化硫与氯气发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl
64、酸雨的形成:2SO2+O22SO3 粉尘等催化
SO3+H2O=H2SO4
SO2+H2OH2SO3
2H2SO3+O2=2H2SO4
65、海水提镁第一步:Mg+2H+=Mg2++H2↑ (盐酸、稀硫酸)
66、镁与氮气的反应:3Mg+N2=Mg3N2 点燃
67、镁与二氧化碳反应:2Mg+CO2=2MgO+C 点燃 (镁着火不能用二氧化碳扑灭)
68、海水提溴单质:2Br-+Cl2=Br2+2Cl-
69、半导体硅与氧气的反应:Si+O2=SiO2 Δ(自然界没有游离态的硅)
70、工业上制粗硅:SiO2+2C=Si+2CO↑ 高温 (光导纤维、沙子和石英的主要成分是SiO2)
71、硅与氟气的反应:Si+2F2=SiF4
72、硅与氢氟酸的反应:Si+4HF=SiF4+2H2
73、制作黏合剂:Si+2NaOH+H2O=Na2SiO3+2H2↑
74、玻璃与烧碱反应:SiO2+2NaOH=Na2SiO3+H2O (Na2SiO3的水溶液称为水玻璃)
75、二氧化硅与碱性氧化物的反应:SiO2+CaO=CaSiO3 高温
76、刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O
77、工业制玻璃:
CaCO3+SiO2=CaSiO3+CO2↑ 高温
Na2CO3+SiO2=Na2SiO3+CO2↑ 高温
78、金属铝在氧气中燃烧:4Al+3O2=2Al2O3 点燃
79、铝热反应:2Al+Fe2O3=Al2O3+2Fe高温
(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)
80、金属铝与酸的反应:2Al+6HCl=2AlCl3+3H2↑
81、金属铝与碱的反应:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ (四羟基合铝酸钠)
82、实验室制氢氧化铝:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(白色沉淀)
83、氢氧化铝溶于强酸中:Al(OH)3+3H+=Al3++3H2O
84、氢氧化铝溶于强碱中:
Al(OH)3+OH-=[Al(OH)4]- (四羟基合铝酸根离子)
85、氧化铝溶于强酸:
Al2O3+6H+=2Al3++3H2O (氧化铝为两性氧化物)
86、氧化铝溶于强碱:Al2O3+2OH-+3H2O=2[Al(OH)4]-
87、碱式碳酸铜的制取:2Cu+O2+H2O+CO2=Cu2(OH)2CO3 (绿色)
88、铜与氧气的反应:Cu+O2=2CuO Δ
89、铜与硫粉的反应:2Cu+S=Cu2S Δ
90、4CuO=2Cu2O+O2↑ 高温 (黑色物质变为红色物质)
91、CuSO4·5H2O=CuSO4+5H2O↑ Δ (蓝色晶体变为白色粉末)
92、氯化铝与少量的氢氧化钠反应:Al3++3OH-=Al(OH)3↓
93、氯化铝与过量的氢氧化钠反应:Al3++4OH-=[Al(OH)4]-
94、四羟基合铝酸根离子与酸的反应:[Al(OH)4]-+H+=H2O+Al(OH)3↓
95、实验室制取氯气:
4HCl(浓)+MnO2 =MnCl2+Cl2↑+2H2O Δ (黄绿色气体、有毒、密度比空气大)
96、实验室制取二氧化碳:
CaCO3+2HCl=CaCl2+H2O+CO2↑ (无色无味、密度比空气大,溶于水)
高一化学必修一知识记忆口诀
01物质的量
一摩尔微粒有几多?常数"阿佛加德罗";摩尔质量是几何?分子(原子)量值单位克每摩;一摩气体"升"多少?标况二十二点四;摩尔计算变化多,数目、质量、体积、浓度要灵活。
02物质的量浓度溶液配制
算称量取步骤清,溶解转移再定容。室温洗涤莫忘记,摇匀标签便告成。
【解释】 1.算称量取步骤清,溶解转移再定容:这两句的意思说明了摩尔溶液配制的步骤是:计算、称量、(或量取)、溶解、转移、定容。
2.室温洗涤莫忘记:"室温"的意思是说溶解时往往因溶解的放热而使溶液的温度升高,故必须冷至室温以后再转移定容。"洗涤"的意思是指移液后,必须用蒸馏水洗涤烧杯和玻璃棒(2-3次),并将洗涤液皆并入容量瓶中,然后再定容。
3.摇匀标签便告成:"摇匀"的意思是说定容后盖好瓶塞,用食指顶住瓶塞,用另一指手的手指托住瓶底,把容量瓶倒转和摇动多次,使溶液混合均匀;"标签"的意思是说要贴好标签,标明溶液浓度和配制的日期。
03一定物质的量浓度的溶液配制"八步曲"
摩尔溶液处处用,配制"八步"记心中;第一计算溶质量,固算克数液毫升;二是计算称量准,固用天平液量筒;三置溶液于烧杯,加水搅动促全溶;第四注入容量瓶,杯嘴抵棒莫乱行;五要两洗杯内壁,洗液全部注入瓶;第六振荡容量瓶,混合均匀要记清;七要加水近刻度,再用滴管来定容;第八加塞再摇动,反复倒转即成功。注:①要用蒸馏水洗。
04容量瓶的使用
精确配液容量瓶,用前查洗记心中,溶解药品用烧杯,静置片刻移瓶中,转移溶液洗三遍,溶剂一次勿加成,快到刻度滴管加,摁塞倒立再摇动.
05离子方程式1
书写离子方程式,记住步骤共有四。物质易溶易电离,离子形式来表示。气体难溶难电离,表示则以化学式。微溶反应写离子,生成却写化学式。写完左右查守恒,原子电荷要看清。
06离子方程式2
客观事实要遵从,书写形式分异同,生成符号要写对,质量电荷要守恒。
07离子共存溶解性口诀
(也可判断离子方程式书写时的拆与不拆)钾钠铵硝皆可溶,盐酸除银亚汞;硫酸不溶有钡铅,碳酸只溶钾钠铵,溶碱只有钾钠和钡氨。
【解释】 钾盐、钠盐、铵盐和硝酸盐都溶于水;盐酸盐里除氯化银AgCl和氯化亚汞Hg2Cl2外都溶;硫酸盐中不溶的是硫酸钡BaSO4和硫酸铅PbSO4;其余几类盐,碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,只有相应的钾盐、钠盐和铵盐可溶。最后说碱类,溶碱只有钾钠和钡氨。(氢氧化钾KOH、氢氧化钠NaOH、氢氧化钡Ba(OH)2和氨水NH3·H2O可溶)。另有几种微溶物,可单独记住。(氢氧化钙微溶)
08氧化还原反应关键词联想记忆法
升失氧、降得还。
【解释】 化合价升高→失去电子→被氧化→是还原剂。化合价降低→得到电子→被还原→是氧化剂。
09金属活动顺序表口诀
(初中) 钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。(高中) 钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
10钠与水反应
(1)芙蓉又想红【解释】 浮熔游响红
(2)钠浮于水,熔成球。球儿闪亮,四处游。有"嘶儿"声,溶液红。
11苏打辨析
大苏打,小苏打,纯碱俗名叫"苏打",苏打、苏打混一沓,到底谁是真"苏打"?阿哥硫代硫酸钠,定影"海波"就是它,化工、制革、除氯剂,它的俗名"大苏打"。阿弟酸式碳酸钠,重碳酸钠也是它,灭火、焙粉、抑酸剂,俗名叫做"小苏打"。纯碱学名碳酸钠,它的译名叫"苏打",纺织、造纸、洗涤剂,纯碱才是真"苏打"。化学世界三"苏打",性质用途有异差,认清组成分子式,三个"苏打"不打架。
【解释】 大苏打分子式:Na2S2O3,苏打分子式:Na2CO3,小苏打分子式:NaHCO3。
12铝
典型两性元素铝,第三主族三周期,氧化薄膜质致密,保护内部不腐蚀,与酸与碱均反应,各生铝盐放氢气,氢氧化铝,氧化铝,典型两性"三代"齐。
【解释】 ①"三代"指铝,氧化铝和氢氧化铝。
13铁
原子序数二十六,八族元素排第一;外层电子有两个,次层电子能失一;遇到强、弱氧化剂,形成三价或亚铁;棕黄色和浅绿色,判断铁盐和亚铁;硫氢化钾作试剂,三价离子液变赤。
14氯中燃烧的特点
钠燃剧烈产白烟,铜燃有烟呈棕黄,铁燃有烟亦棕黄,氢燃火焰苍白色,磷燃氯中烟雾茫。
15氯气的制取实验
二氧化锰盐酸逢,隔网热瓶氯气生。盐水硫酸除杂质,吸收通入火碱中。
【解释】 1.二氧化锰盐酸逢,隔网热瓶氯气生。这句的意思是说在实验室中是用二氧化锰与浓盐酸在烧瓶中隔石棉网的方法来制取氯气[联想:"隔网加热杯和瓶"]。
2.盐水硫酸除杂质:"盐水"指饱和食盐水,"杂质"指混在氯气中的氯化氢和水蒸气。这句的意思是说使气体依次通过饱和食盐水和浓硫酸分别除掉混在氯气中的氯化氢和水蒸气【联想:有时也用水除氯化氢,但水却溶解了一部分氯气,不如用饱和食盐水好。因为氯气在饱和食盐水中的溶解度很小。 】
3.吸收通入火碱中:的意思是说多余的氯气必须通入火碱溶液中吸收掉(因为氯气有毒)。
高一化学必修一必考知识点归纳相关文章:
★ 化学高中必修一知识点归纳整理大全
★ 人教版高一化学必修一知识点储备2021
★ 关于高中化学必修一知识点归纳
★ 化学必修一详细复习知识点整理2021
★ 关于化学必修一知识点总结
★ 关于高一化学必修一知识点总结大全
★ 有关化学高一必修一知识点总结
★ 硅及其化合物Si高中化学必修一知识点
★ 化学必修一复习知识点精华整理2021








 上海工商
上海工商