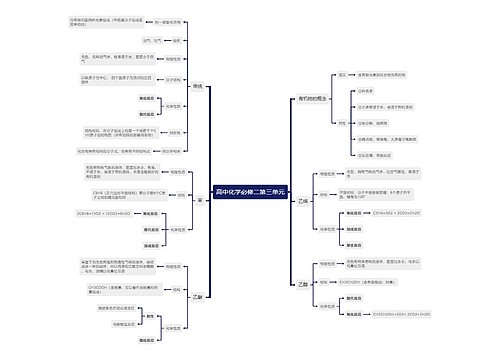
高中化学学科知识:有效碰撞思维导图

树图网为帮助广大教师资格备考考生复习,整理了有效碰撞知识点,希望对大家有帮助!
树图思维导图提供 高中化学学科知识:有效碰撞 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学学科知识:有效碰撞 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7c248085d537172614615a3ddd88b67d
思维导图大纲
高中化学学科知识:有效碰撞思维导图模板大纲
针对能引起化学反应的碰撞叫做有效碰撞(effective collision) 。全国树图网根据《化学学科知识与教学能力》整理了有效碰撞相关知识点,希望对广大考生备考有所帮助。
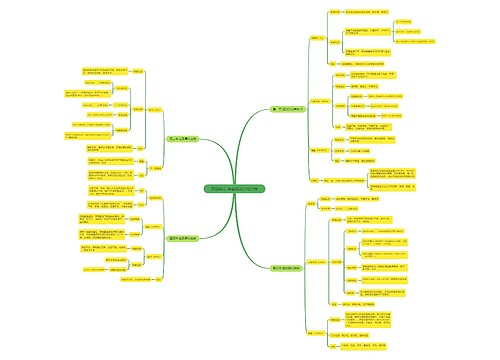
一、有效碰撞概念:
能够发生反应的分子或者原子之间的碰撞。
反应发生的先决条件就是反应物分子之间发生碰撞,但不是每一次碰撞都能够导致反应发生,必须是既具有足够能量又有合适取向的分子的碰撞才是有效碰撞。碰撞的效率越高,则发生反应的速率越大。
二、有效碰撞的条件:
反应物分子(或原子)必须发生碰撞;
分子必须是具有一定能量的活化分子;
活化分子发生碰撞时必须有合适的取向。
三、活化分子和活化能
1.活化分子
分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。若分子碰撞取向合适,就发生化学反应;若分子碰撞取向不合适,则化学反应不能发生。也就说,只有活化分子以合适的取向发生碰撞以后,才能使分子内的化学键断裂,从而引发化学反应。一句话,(具有较高能量的)活化分子按照合适的取向所发生的有效碰撞才能发生化学反应。
2.活化能
为了把"有效碰撞"概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出的那部分能量称作活化能,即(基元反应的)活化能是活化分子平均能量与普通反应物分子平均能量的差值。
注:活化能相当于化学反应的"门槛",对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应改变反应历程降低反应的活化能来提高反应速率的。
四、影响有效碰撞的条件
(1)浓度:增大反应物浓度→单位体积内活化分子数增多→单位时间内有效碰撞次数增多→反应速率增大。
(2)温度:温度升高时,分子运动速率加快,有效碰撞机会增多,反应速率加快。
(3)压强:对于有气体参加的反应,当其他条件不变,增加压强时,气体的体积减小,浓度增大,分子间的有效碰撞机会增多,故反应速率加快。
(4)催化剂:催化剂能极大的降低反应的活化能,从而增大活化分子百分数,使反应速率加快。
相关思维导图模板

树图思维导图提供 服装与现代服饰设计 在线思维导图免费制作,点击“编辑”按钮,可对 服装与现代服饰设计 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4fc307ae7dd3ab106471879eeb384d44


树图思维导图提供 心疗与各学科之间的关系 在线思维导图免费制作,点击“编辑”按钮,可对 心疗与各学科之间的关系 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:29b3785948504bfe1a5bd431d0e7b18f





 上海工商
上海工商