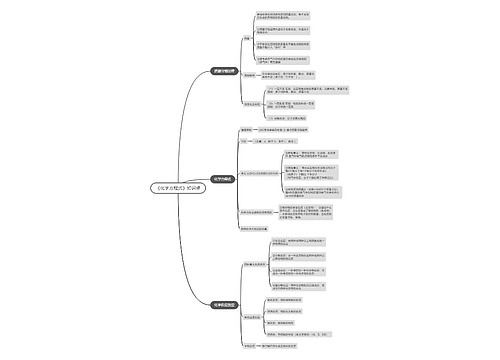
高二化学重点知识点 你需要的都在这里思维导图
如果把高中三年去挑战高考看作一次越野长跑的话,那么高中二年级是这个长跑的中段。与起点相比,它少了许多的鼓励、期待,与终点相比,它少了许多的掌声、加油声。它是孤身奋斗的阶段,是一个耐力、意志、自控力比拚的阶段。但它同时是一个厚实庄重的阶段,这个时期形成的优势有实力。树图网高二频道为你整理了《高二化学重点知识点你需要的都在这里》,学习路上,树图网为你加油!
树图思维导图提供 高二化学重点知识点 你需要的都在这里 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学重点知识点 你需要的都在这里 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e3fb0c3e93f77cbbd7c8ce52467b0b79
思维导图大纲
高二化学重点知识点 你需要的都在这里思维导图模板大纲
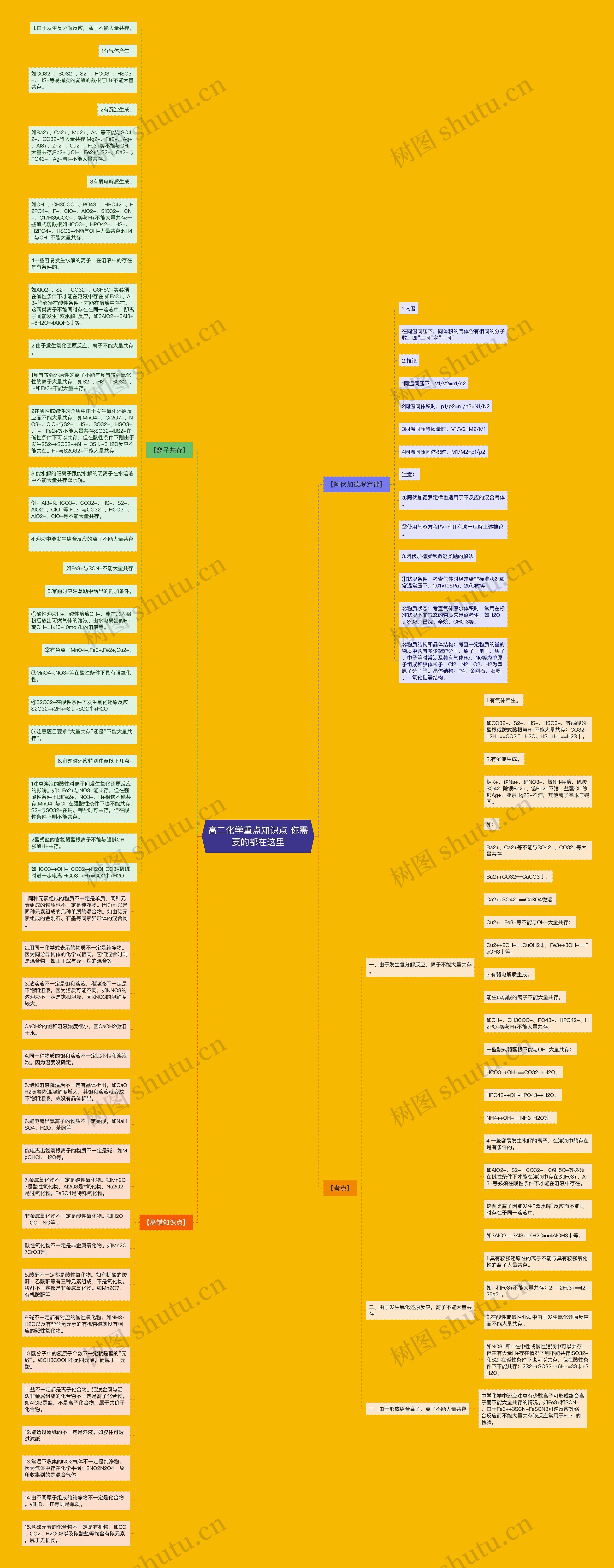
【阿伏加德罗定律】
1.内容
在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。
2.推论
1同温同压下,V1/V2=n1/n2
2同温同体积时,p1/p2=n1/n2=N1/N2
3同温同压等质量时,V1/V2=M2/M1
4同温同压同体积时,M1/M2=ρ1/ρ2
注意:
①阿伏加德罗定律也适用于不反应的混合气体。
②使用气态方程PV=nRT有助于理解上述推论。
3.阿伏加德罗常数这类题的解法
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒分子、原子、电子、质子、中子等时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。
【离子共存】
1.由于发生复分解反应,离子不能大量共存。
1有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
2有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
3有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
4一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4AlOH3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
1具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
2在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存双水解。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe3+与SCN-不能大量共存;
5.审题时应注意题中给出的附加条件。
①酸性溶液H+、碱性溶液OH-、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+。
③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6.审题时还应特别注意以下几点:
1注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下即Fe2+、NO3-、H+相遇不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
2酸式盐的含氢弱酸根离子不能与强碱OH-、强酸H+共存。
如HCO3-+OH-=CO32-+H2OHCO3-遇碱时进一步电离;HCO3-+H+=CO2↑+H2O
【考点】
一、由于发生复分解反应,离子不能大量共存。
1.有气体产生。
如CO32-、S2-、HS-、HSO3-、等弱酸的酸根或酸式酸根与H+不能大量共存:CO32-+2H+==CO2↑+H2O、HS-+H+==H2S↑。
2.有沉淀生成。
钾K+、钠Na+、硝NO3-、铵NH4+溶,硫酸SO42-除钡Ba2+、铅Pb2+不溶,盐酸Cl-除银Ag+、亚汞Hg22+不溶,其他离子基本与碱同。
如:
Ba2+、Ca2+等不能与SO42-、CO32-等大量共存:
Ba2++CO32==CaCO3↓、
Ca2++SO42-==CaSO4微溶;
Cu2+、Fe3+等不能与OH-大量共存:
Cu2++2OH-==CuOH2↓,Fe3++3OH-==FeOH3↓等。
3.有弱电解质生成。
能生成弱酸的离子不能大量共存,
如OH-、CH3COO-、PO43-、HPO42-、H2PO-等与H+不能大量共存,
一些酸式弱酸根不能与OH-大量共存:
HCO3-+OH-==CO32-+H2O、
HPO42-+OH-=PO43-+H2O、
NH4++OH-==NH3·H2O等。
4.一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子因能发生“双水解”反应而不能同时存在于同一溶液中,
如3AlO2-+3Al3++6H2O==4AlOH3↓等。
二、由于发生氧化还原反应,离子不能大量共存
1.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如I-和Fe3+不能大量共存:2I-+2Fe3+==I2+2Fe2+。
2.在酸性或碱性介质中由于发生氧化还原反应而不能大量共存。
如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下不能共存:2S2-+SO32-+6H+=3S↓+3H2O。
三、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如Fe3+和SCN-,由于Fe3++3SCN-FeSCN3可逆反应等络合反应而不能大量共存该反应常用于Fe3+的检验。
【易错知识点】
1.同种元素组成的物质不一定是单质,同种元素组成的物质也不一定是纯净物。因为可以是同种元素组成的几种单质的混合物。如由碳元素组成的金刚石、石墨等同素异形体的混合物。
2.用同一化学式表示的物质不一定是纯净物。因为同分异构体的化学式相同,它们混合时则是混合物。如正丁烷与异丁烷的混合等。
3.浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。因为溶质可能不同,如KNO3的浓溶液不一定是饱和溶液,因KNO3的溶解度较大。
CaOH2的饱和溶液浓度很小,因CaOH2微溶于水。
4.同一种物质的饱和溶液不一定比不饱和溶液浓。因为温度没确定。
5.饱和溶液降温后不一定有晶体析出。如CaOH2随着降温溶解度增大,其饱和溶液就变成不饱和溶液,故没有晶体析出。
6.能电离出氢离子的物质不一定是酸。如NaHSO4、H2O、苯酚等。
能电离出氢氧根离子的物质不一定是碱。如MgOHCl、H2O等。
7.金属氧化物不一定是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是*氧化物,Na2O2是过氧化物,Fe3O4是特殊氧化物。
非金属氧化物不一定是酸性氧化物。如H2O、CO、NO等。
酸性氧化物不一定是非金属氧化物。如Mn2O7CrO3等。
8.酸酐不一定都是酸性氧化物。如有机酸的酸酐:乙酸酐等有三种元素组成,不是氧化物。酸酐不一定都是非金属氧化物。如Mn2O7、有机酸酐等。
9.碱不一定都有对应的碱性氧化物。如NH3·H2O以及有些含氮元素的有机物碱就没有相应的碱性氧化物。
10.酸分子中的氢原子个数不一定就是酸的“元数”。如CH3COOH不是四元酸,而属于一元酸。
11.盐不一定都是离子化合物。活泼金属与活泼非金属组成的化合物不一定是离子化合物。如AlCl3是盐,不是离子化合物,属于共价子化合物。
12.能透过滤纸的不一定是溶液。如胶体可透过滤纸。
13.常温下收集的NO2气体不一定是纯净物。因为气体中存在化学平衡:2NO2N2O4,故所收集到的是混合气体。
14.由不同原子组成的纯净物不一定是化合物。如HD、HT等则是单质。
15.含碳元素的化合物不一定是有机物。如CO、CO2、H2CO3以及碳酸盐等均含有碳元素,属于无机物。
相关思维导图模板

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826








 上海工商
上海工商