高一化学上册知识要点思维导图

进入高中后,很多新生有这样的心理落差,比自己成绩优秀的大有人在,很少有人注意到自己的存在,心理因此失衡,这是正常心理,但是应尽快进入学习状态。树图网高一频道为正在努力学习的你整理了《高一化学上册知识要点》,希望对你有帮助!
树图思维导图提供 高一化学上册知识要点 在线思维导图免费制作,点击“编辑”按钮,可对 高一化学上册知识要点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:6fd7e5944e25678048d1b2999118f79b
思维导图大纲
高一化学上册知识要点思维导图模板大纲
高一化学上册知识要点一
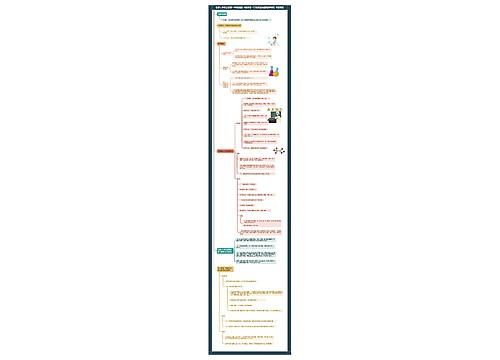
化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量均取正值来表示。计算公式:υ=△C/△t
①单位:mol/L·s或mol/L·min
②B为溶液或气体,若B为固体或纯液体不计算速率。
③重要规律:以mA+nBpC+qD而言,用A、B浓度的减少或C、D浓度的增加所表示的化学反应速率之间必然存在如下关系:
VA:VB:VC:VD=m:n:c:d。
影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的主要因素。
外因:外界条件对化学反应速率有一定影响
①温度:升高温度,增大速率;
②催化剂:一般加快反应速率正催化剂。
③浓度:增加反应物的浓度,增大速率溶液或气体才有浓度可言。
④压强:增大压强,增大速率适用于有气体参加的反应。
⑤其它因素:如光射线、固体的表面积颗粒大小、反应物的状态溶剂、原电池等也会改变化学反应速率。
高一化学上册知识要点二
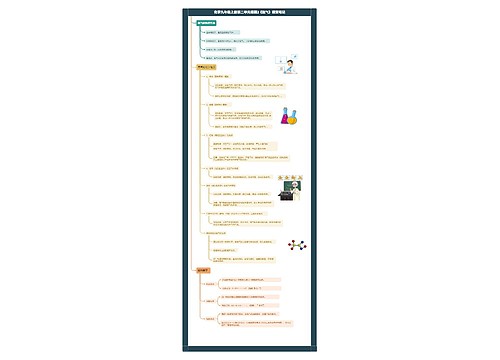
一、原子半径
同一周期稀有气体除外,从左到右,随着原子序数的递增,元素原子的半径递减;
同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价
正化合价和最低负化合价
同一周期中,从左到右,随着原子序数的递增,元素的正化合价递增从+1价到+7价,第一周期除外,第二周期的O、F元素除外;
最低负化合价递增从-4价到-1价第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
三、元素的金属性和非金属性
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;
同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;
四、单质及简单离子的氧化性与还原性
同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
五、价氧化物所对应的水化物的酸碱性
同一周期中,元素价氧化物所对应的水化物的酸性增强碱性减弱;
同一族中,元素价氧化物所对应的水化物的碱性增强酸性减弱。
六、单质与氢气化合的难易程度
同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易;
同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。
七、气态氢化物的稳定性
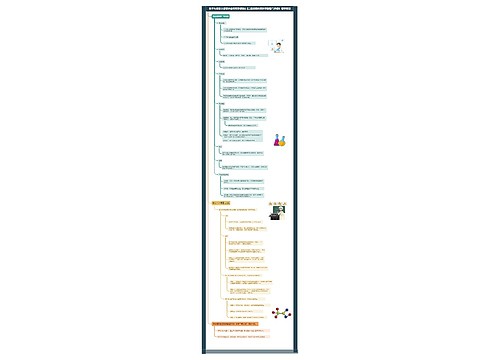
同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强;同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化。
随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。元素的价氢氧化物的碱性越强,元素金属性就越强;价氢氧化物的酸性越强,元素非金属性就越强。
元素的气态氢化物越稳定,非金属性越强。同一族的元素性质相近。具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因。以上规律不适用于稀有气体。还有一些根据元素周期律得出的结论:元素的金属性越强,其第一电离能就越小;非金属性越强,其第一电子亲和能就越大。同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子。周期表左边元素常表现金属性,从上至下依次增大,从左至右一次减小。周期表右边元素常表现非金属性,从上至下依次减小,从左至右一次增大。
相关思维导图模板

树图思维导图提供 慢性肺源性心脏病 在线思维导图免费制作,点击“编辑”按钮,可对 慢性肺源性心脏病 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d2393119f432b1d461ee990f7eefeb6a

树图思维导图提供 孙某诉某县公安局行政处罚案 在线思维导图免费制作,点击“编辑”按钮,可对 孙某诉某县公安局行政处罚案 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:ad985766ae36f1fff362354740ebcf8b













 上海工商
上海工商