化学转化率受什么影响思维导图
会员免费下载或30积分
会员免费使用或30积分
心不动则不痛 浏览量:12023-01-13 01:44:57
已被使用0次
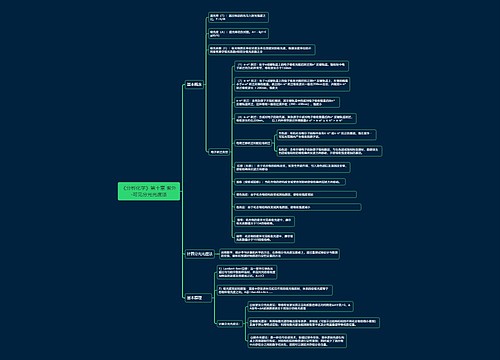
转化率是由平衡移到决定的。当因素能使平衡向正反应方向移动,即转化率增大了,反之则减少。能引起平衡移到的因素通常有:温度、压强、浓度。若正反应是吸热反应,升高温度,转化率升高,降低温度,转化率降低;若正反应为放热反应,升高温度,转化率降低,降低温度,转化率升高。
树图思维导图提供 化学转化率受什么影响 在线思维导图免费制作,点击“编辑”按钮,可对 化学转化率受什么影响 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4cae4b9fd2bf0fc2c740155cfeb79ef4
思维导图大纲
化学转化率受什么影响思维导图模板大纲
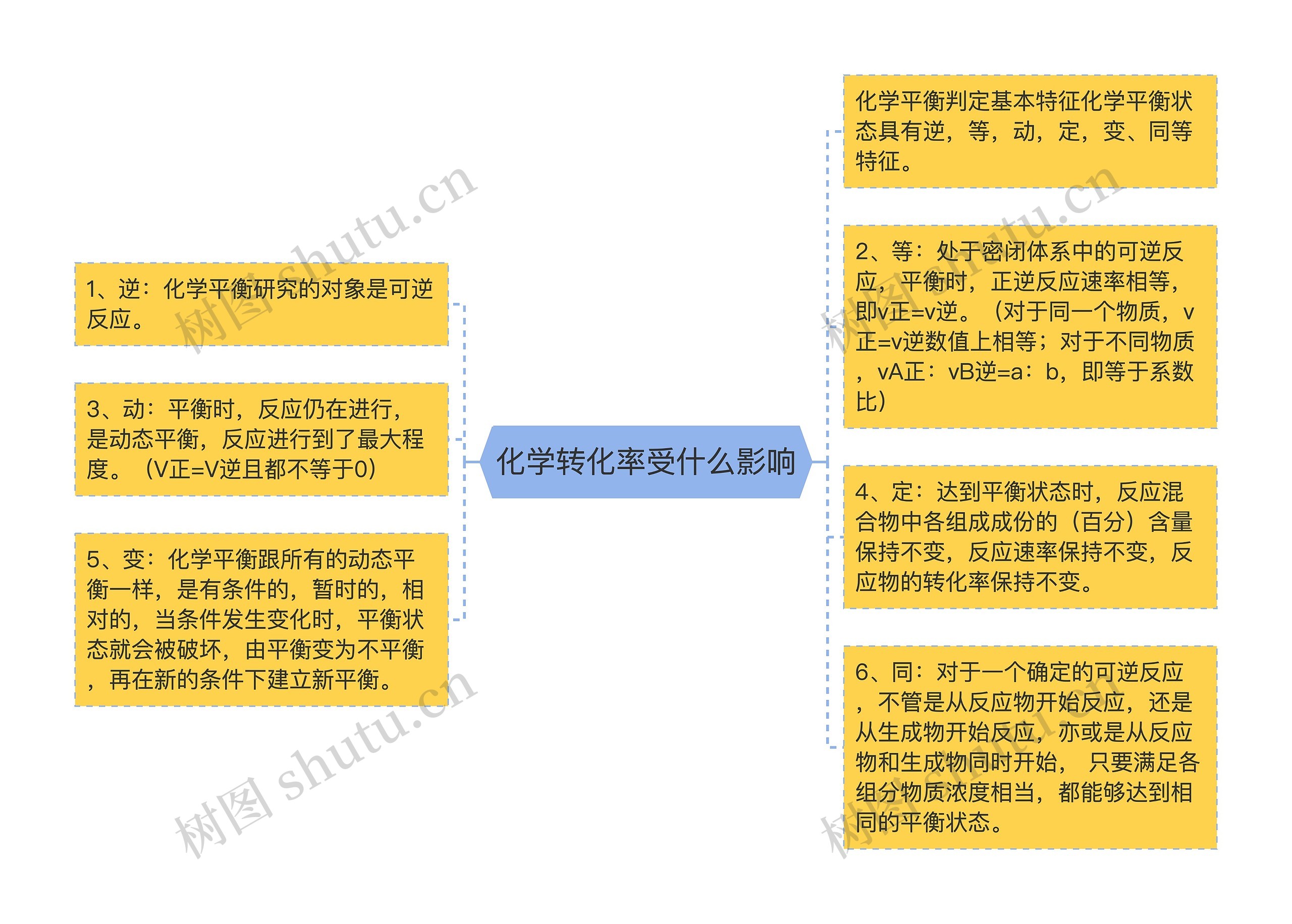
化学平衡判定基本特征化学平衡状态具有逆,等,动,定,变、同等特征。
1、逆:化学平衡研究的对象是可逆反应。
2、等:处于密闭体系中的可逆反应,平衡时,正逆反应速率相等,即v正=v逆。(对于同一个物质,v正=v逆数值上相等;对于不同物质,vA正:vB逆=a:b,即等于系数比)
3、动:平衡时,反应仍在进行,是动态平衡,反应进行到了最大程度。(V正=V逆且都不等于0)
4、定:达到平衡状态时,反应混合物中各组成成份的(百分)含量保持不变,反应速率保持不变,反应物的转化率保持不变。
5、变:化学平衡跟所有的动态平衡一样,是有条件的,暂时的,相对的,当条件发生变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建立新平衡。
6、同:对于一个确定的可逆反应,不管是从反应物开始反应,还是从生成物开始反应,亦或是从反应物和生成物同时开始, 只要满足各组分物质浓度相当,都能够达到相同的平衡状态。










 上海工商
上海工商