新药注册相关政策思维导图
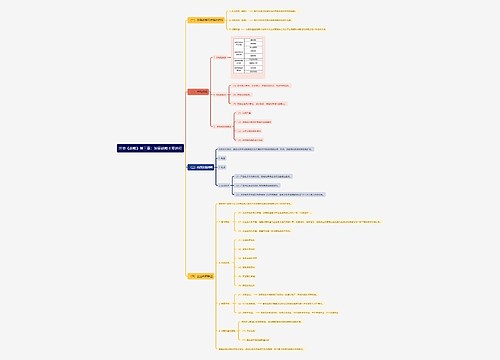
第十三条 申请人应当提供充分可靠的研究数据,证明药品的安全性、有效性和质量可控性,并对全部资料的真实性负责。 第十四条 药品注册所报送的资料引用文献应当注明著作名称、刊物名称及卷、期、页等;未公开发表的文献资料应当提供资料所有者许可使用的证明文件。外文资料应当按照要求提供中文译本。
树图思维导图提供 新药注册相关政策 在线思维导图免费制作,点击“编辑”按钮,可对 新药注册相关政策 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:935ae05e1a0b716101798505c955d98d
思维导图大纲
新药注册相关政策思维导图模板大纲
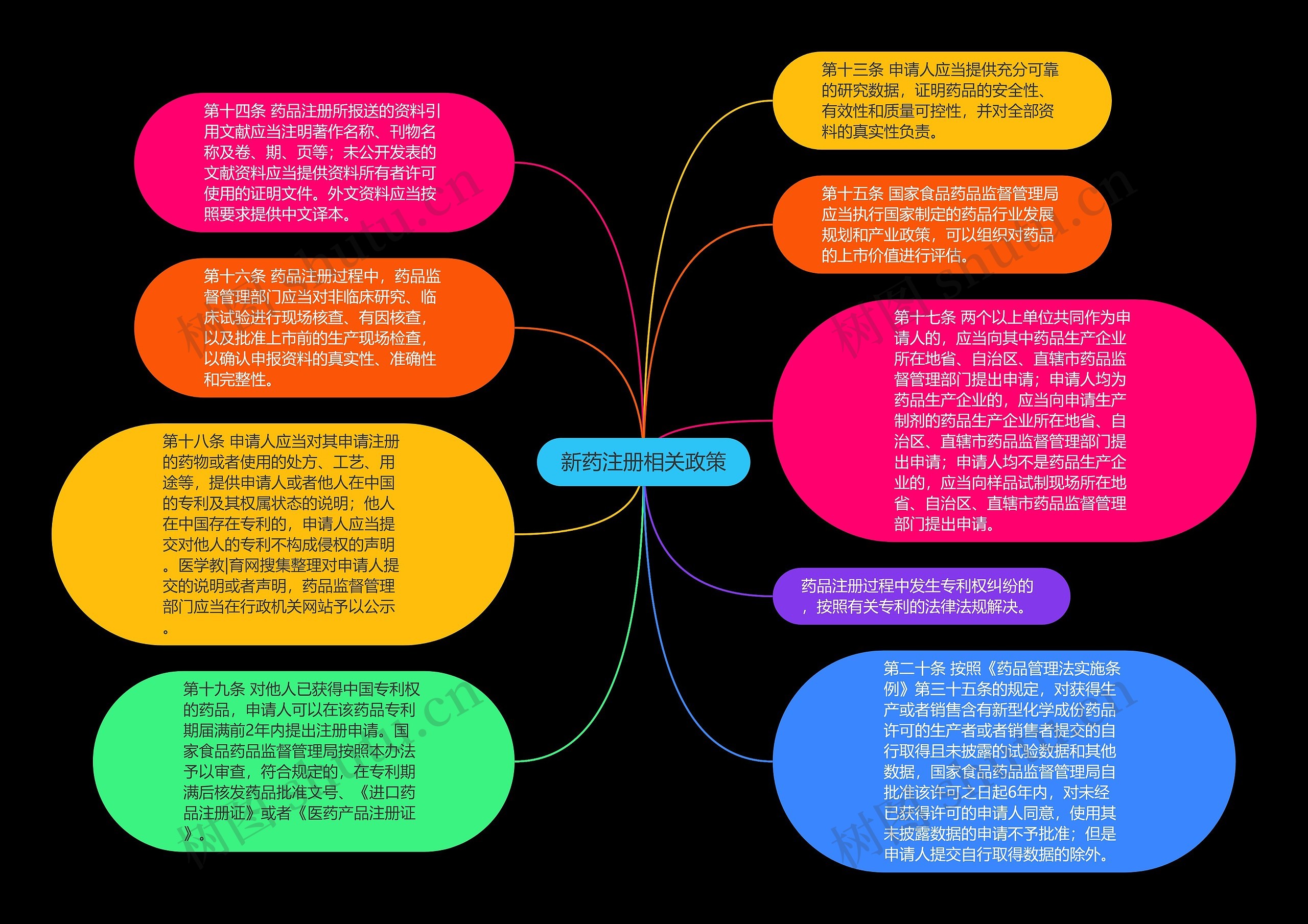
第十三条 申请人应当提供充分可靠的研究数据,证明药品的安全性、有效性和质量可控性,并对全部资料的真实性负责。
第十四条 药品注册所报送的资料引用文献应当注明著作名称、刊物名称及卷、期、页等;未公开发表的文献资料应当提供资料所有者许可使用的证明文件。外文资料应当按照要求提供中文译本。
第十五条 国家食品药品监督管理局应当执行国家制定的药品行业发展规划和产业政策,可以组织对药品的上市价值进行评估。
第十六条 药品注册过程中,药品监督管理部门应当对非临床研究、临床试验进行现场核查、有因核查,以及批准上市前的生产现场检查,以确认申报资料的真实性、准确性和完整性。
第十七条 两个以上单位共同作为申请人的,应当向其中药品生产企业所在地省、自治区、直辖市药品监督管理部门提出申请;申请人均为药品生产企业的,应当向申请生产制剂的药品生产企业所在地省、自治区、直辖市药品监督管理部门提出申请;申请人均不是药品生产企业的,应当向样品试制现场所在地省、自治区、直辖市药品监督管理部门提出申请。
第十八条 申请人应当对其申请注册的药物或者使用的处方、工艺、用途等,提供申请人或者他人在中国的专利及其权属状态的说明;他人在中国存在专利的,申请人应当提交对他人的专利不构成侵权的声明。医学教|育网搜集整理对申请人提交的说明或者声明,药品监督管理部门应当在行政机关网站予以公示。
药品注册过程中发生专利权纠纷的,按照有关专利的法律法规解决。
第十九条 对他人已获得中国专利权的药品,申请人可以在该药品专利期届满前2年内提出注册申请。国家食品药品监督管理局按照本办法予以审查,符合规定的,在专利期满后核发药品批准文号、《进口药品注册证》或者《医药产品注册证》。
第二十条 按照《药品管理法实施条例》第三十五条的规定,对获得生产或者销售含有新型化学成份药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据,国家食品药品监督管理局自批准该许可之日起6年内,对未经已获得许可的申请人同意,使用其未披露数据的申请不予批准;但是申请人提交自行取得数据的除外。
相关思维导图模板

树图思维导图提供 中国临床试验受试者隐私权保护的相关问题及解决策略 在线思维导图免费制作,点击“编辑”按钮,可对 中国临床试验受试者隐私权保护的相关问题及解决策略 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38e14f03459127cad536b763e9539599

树图思维导图提供 配置网络和firewall防火墙 在线思维导图免费制作,点击“编辑”按钮,可对 配置网络和firewall防火墙 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a4deb8c2436c6e677fbc29992596caee








 上海工商
上海工商