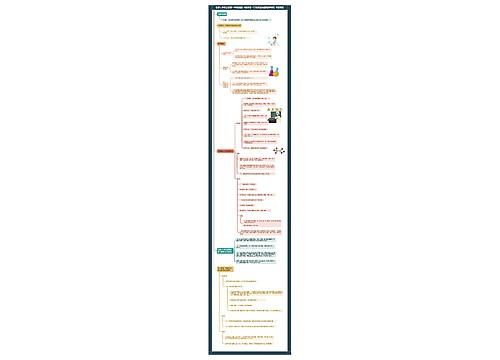
教师资格证化学学科知识:离子浓度的对比思维导图

树图网为帮助广大教师资格备考考生复习,整理了化学学科离子浓度的对比,希望对大家有帮助!
树图思维导图提供 教师资格证化学学科知识:离子浓度的对比 在线思维导图免费制作,点击“编辑”按钮,可对 教师资格证化学学科知识:离子浓度的对比 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b1dee36f7a5494ea4716a62863dad90a
思维导图大纲
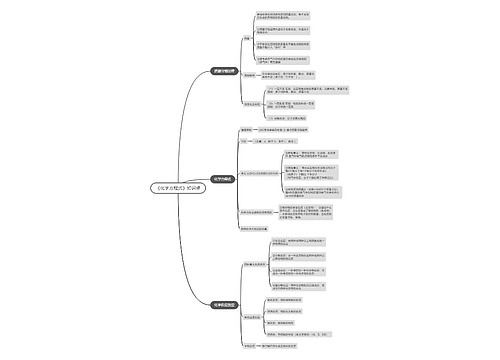
教师资格证化学学科知识:离子浓度的对比思维导图模板大纲
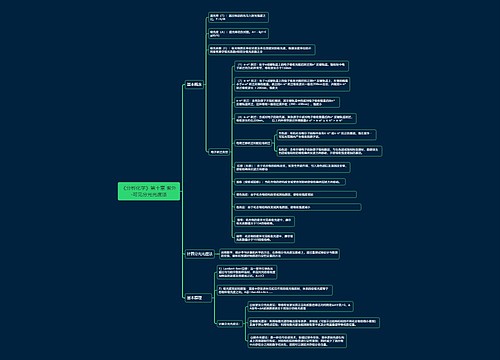
离子浓度,溶液中含某种离子的总量与体积之比,用n/V表示,单位一般为mol/L。全国教师资格考试网根据《化学学科知识与教学能力》整理了离子浓度对比相关知识点,希望对广大考生备考有所帮助。
一、单一溶液
1.酸
①一元弱酸溶液:lmol/L CH3COOH,c(H+)>c(CH3COO-)>c(OH-)
②多元弱酸溶液:lmol/L H2S酸,c(H+)>c(HS-)>c(S2-)>c(OH-)
通过上面两种弱酸溶液中离子浓度大小的比较,可以发现对于弱酸溶液而言,所有离子中氢离子浓度是最大的。但是多元弱酸需要考虑多步电离,且以第一步电离为主,因此在比较时第一步电离产生的离子浓度会更大。
2.碱
lmol/L NH3·H2O,c(OH-)>c(NH4+)>c(H+)
弱碱溶液中,电离是微弱的,所有离子中氢氧根离子浓度是最大的。不论是一元弱碱还是多元弱碱,都按照一步电离进行比较。
3.盐
①一元强酸弱碱盐或一元强碱弱酸盐溶液:
0.1mol/L NH4Cl溶液,c(Cl-)>c(NH4+)>c(H+)>c(OH-)
0.1mol/L CH3COONa溶液,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
在一元强酸弱碱盐或一元强碱弱酸盐溶液中,弱碱阳离子或者弱酸根阴离子能够发生水解,但是一定要注意水解一般是少量的,有这样一个微弱观念可以正确处理离子浓度之间的关系。
②多元弱酸正盐溶液:
0.1mol/L Na2CO3溶液,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
对于多元弱酸的正盐溶液,多元弱酸根离子会发生水解并且水解是多步的,其中以第一步水解为主,同时也要时刻留意水解是微弱的,这样才能很好的比较出各种离子的浓度大小。
③多元弱酸酸式盐溶液:
a.电离程度大于水解程度:在0.1mol/L NaHSO3溶液中,c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
b.水解程度大于电离程度:0.1mol/L NaHCO3溶液,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)
多元弱酸酸式盐溶液进行离子浓度大小比较相对复杂,因为既存在着水解过程又存在电离过程,所以我们要充分考虑水解程度与电离程度的相对大小。HSO3-离子的电离程度要大于水解程度,所以c(HSO3-)>c(SO32-)>c(H2SO3),那么就可以比较出各离子浓度了;HCO3-离子的电离程度要小于水解程度,所以c(HCO3-)>c(H2CO3)>c(CO32-),同样也可以比较出各离子的浓度。
二、混合溶液
1.互不反应
①电离为主:
a.0.1mol/L NH3·H2O和0.1mol/L NH4Cl溶液等体积混合,NH3·H2O电离为主:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
b.0.1mol/L CH3COOH和0.1mol/L CH3COONa溶液等体积混合,CH3COOH电离为主:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
根据题干可以看出,上面两组混合溶液均以电离为主,除了直接给出条件外还有另外一种叙述:0.1mol/L NH3·H2O和0.1mol/L NH4Cl溶液等体积混合,溶液显碱性;或是0.1mol/L CH3COOH和0.1mol/L CH3COONa溶液等体积混合,溶液显酸性。这种叙述的情况同样可以判断溶液是电离为主,如0.1mol/L NH3·H2O和0.1mol/L NH4Cl溶液等体积混合,溶液显碱性,说明NH3·H2O溶液的电离程度要大于NH4Cl溶液的水解程度。当以电离为主的时候,我们重点考虑电离的过程。
②水解为主:
0.1mol/L NaCN和0.1mol/L HCN溶液等体积混合呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
0.1mol/L NaCN和0.1mol/L HCN溶液等体积混合呈碱性,则说明NaCN溶液的水解程度要大于HCN溶液的电离程度。那么我们主要考虑溶液的水解过程。
2.互相反应
0.1mol/L NH3·H2O和0.1mol/L HCl溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
对于能够互相反应的混合溶液,要先判断反应的产物,在确定好溶液中的溶质之后就不难判断溶液中离子的浓度了。
三、不同溶液
25℃时,相同物质的量浓度的下列溶液中:
①NH4Cl、②CH3COONH4、③NH4HSO4、④(NH4)2SO4、⑤(NH4)2Fe(SO4)2,c(NH4+)由大到小的顺序为:⑤>④>③>①>②
当不同溶液中同一离子浓度的大小进行比较时,首先要选好参照物,然后看其他离子对该离子的影响,通过分组比较各个击破。①②③可分为一组,以①为参照物,②相当于在①基础上促进NH4+的水解,③相当于在①的基础上抑制NH4+的水解。④⑤可以分为一组,以④为参照物,⑤是在④的基础上抑制NH4+的水解。由此就可以比较出NH4+的浓度大小。
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096

树图思维导图提供 服装与现代服饰设计 在线思维导图免费制作,点击“编辑”按钮,可对 服装与现代服饰设计 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4fc307ae7dd3ab106471879eeb384d44








 上海工商
上海工商