第十章:分子结构思维导图

树图思维导图提供 第十章:分子结构 在线思维导图免费制作,点击“编辑”按钮,可对 第十章:分子结构 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c883734379c3f4611a417b9143f2bfe6
思维导图大纲
第十章:分子结构思维导图模板大纲
共价键理论
经典共价键理论
共价键由成键原子双方提供电子组成共用电子对形成;形成共价键后,提供电子的原子达到惰性气体原子的稳定构型,因而变得稳定
优点:初步揭示了共价键与离子键的区别
局限性
把电子看成是静止不动的负电荷
两个带负电的电子为什么不相互排斥反而相互配对趋于稳定呢
共价键为什么具有方向性
现代价键理论
共价键的形成是两个成键原子轨道相互重叠的结果
价键理论要点
自旋相反未成对电子的原子相互接近时,可形成稳定的共价键
共价键数目取决于原子中未成对电子的数目
成键时,双方原子轨道重叠越多,成键能力越强,形成的共价键越牢固。称之为轨道最大重叠理论
共价键的类型
α键
头碰头重叠,电子云密集在键轴上
重叠程度大,键能大,稳定性高
存在于单键中,共价键的主要成键方式
Π键
肩并肩重叠,电子云密集在键轴的上、下面
重叠程度小,键能小,稳定性低
仅存在于双键或三键中
优点:能说明共价键的形成和特征
局限性:不能说明多原子分子的空间构型
杂化轨道理论
杂化:原子在形成分子时,同一原子中能量相近的不同原子轨道重新组合成一组新轨道的过程。新轨道称为杂化轨道
原子轨道经过杂化
形状变化:一端变肥大,便于最大重叠,成键能力增强
伸展方向改变:轨道在空间取最大夹角,电子对之间斥力最小,成键更稳定
杂化理论要点
原子间形成共价键时,可运用杂化轨道成键
杂化轨道的数目等于参与杂化的原子轨道数目
杂化轨道在空间取尽可能大的键角,使轨道间排斥力最小,使分子具有较小的内能,处于稳定状态
杂化类型
sp杂化
一个ns+一个np原子轨道,组成两个sp杂化轨道
杂化轨道夹角:180°
杂化轨道构型:直线型
sp^2杂化
杂化轨道构成:一个ns+2个np=3个np^2
杂化轨道夹角:120°
轨道构型:平面三角形
sp^3杂化
杂化轨道构成:1个ns+3个np=4个sp^3
杂化轨道夹角:109.5°
轨道构型:正四面体
杂化轨道的类型
等性杂化
成分、能量、形状均相同
都含有单电子或均具有空轨道
与分子构型相同
不等性杂化
成分、能量、形状不完全相同
含有不参加成键的弧对电子
与分子构型不一定相同
优点:杂化轨道理论在解释分子的空间构型方面取得了巨大的成功,对共价键的饱和性和方向性也能做出满意的解释
不足:一个分子的中心原子究竟采取哪种类型的轨道杂化,有时是难以预先确定的,即杂化轨道理论难以预测分子的空间构型
价层电子对互斥理论
价层电子对数=(A价电子+B成键电子±离子电荷数)/2
价层电子对在中心原子周围尽可能互相远离,且对称分布
分子轨道理论
键极=(成键电子数-反键电子数)/2
键极越大,键越稳定
键极为零,原子不可能形成分子
分子间作用力
分子的极性与极化
分子的极性
分子中有一个正电荷中心和一个负电荷中心
若正、负电荷中心重合,则为非极性分子
若正、负电荷中心不重合,则为极性分子
分子极性用偶极矩量度,偶极矩愈大,分子的极性俞强
共价键的极性
常用两原子电负性的差值来表示键的极性
成键原子电负性差值愈大,键的极性愈大
键的极性与分子的极性
双原子分子:分子的极性与键的极性一致
多原子分子:分子是否有极性,不仅取决于共价键的极性,也与分子的空间构型有关
分子的极化
定义:在外电场的作用下,无论是极性分子还是非极性分子都会发生变形,变形分子中电子云与原子核发生相对位移,偶极矩增大,极性增强
分子间作用力
取向力
定义:由于极性分子间的相对取向而产生的分子间的吸引作用
存在方式:极性分子和极性分子之间
影响因素:分子的极性;温度
诱导力
定义:极性分子的永久偶极与诱导偶极之间的相互作用产生的作用力
存在方式:极性分子和极性分子之间、极性分子和非极性分子之间
影响方式:极性分子的偶极矩;非极性分子的变形性
色散力
定义:瞬间偶极产生分子之间作用力
存在方式:各种类型分子及离子
影响因素:分子的变形性
范德华力的特点
存在于分子之间
是静电引力,作用能量小。
作用范围小
不具有方向性和饱和性
大多数分子,色散力是主要的;只有极性大的分子,取向力才比较显著。诱导力通常很小
氢键
氢键的形成
形成条件:氢原子以共价键成键,氢原子连有电负性大、半径小的原子
氢键本质:静电引力
作用大小:介于化学键与范德华力之间
氢键的强弱:F-H···F>O-H···O>O-H···N>N-H···N>O-H···Cl
氢键的分类
分子间氢键
分子内氢键
氢键的特点
只存在于含氢的分子间
具有方向性和饱和性
键长比正常共价键大得多,键能较小,但比范德华力强
不属于化学键本质是静电引力
氢键对物质性质的影响
分子间氢键
熔沸点显著升高
黏度增大
分子内氢键
熔沸点比同类降低
黏度降低
极性溶剂中的溶解度降低;非极性溶剂中的溶解度升高
相关思维导图模板
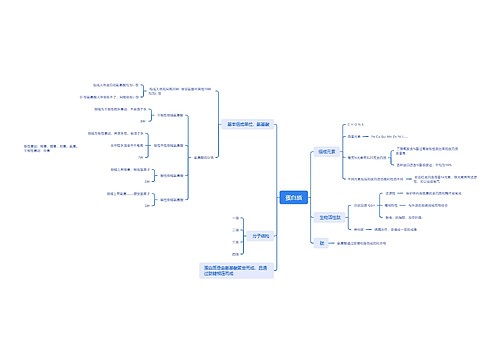

树图思维导图提供 蛋白质思维脑图 在线思维导图免费制作,点击“编辑”按钮,可对 蛋白质思维脑图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:ff4d2b2b9ea458ad126e07b2ba4c670c


树图思维导图提供 蛋白质的结构与功能 在线思维导图免费制作,点击“编辑”按钮,可对 蛋白质的结构与功能 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c2fcb7a15564fd3521245e819231bec1











 上海工商
上海工商