蛋白质化学思维导图
蛋白质化学
树图思维导图提供 蛋白质化学思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 蛋白质化学思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:72c9d8f2de8517a367d1d5e0733b793b
思维导图大纲
蛋白质化学思维导图模板大纲
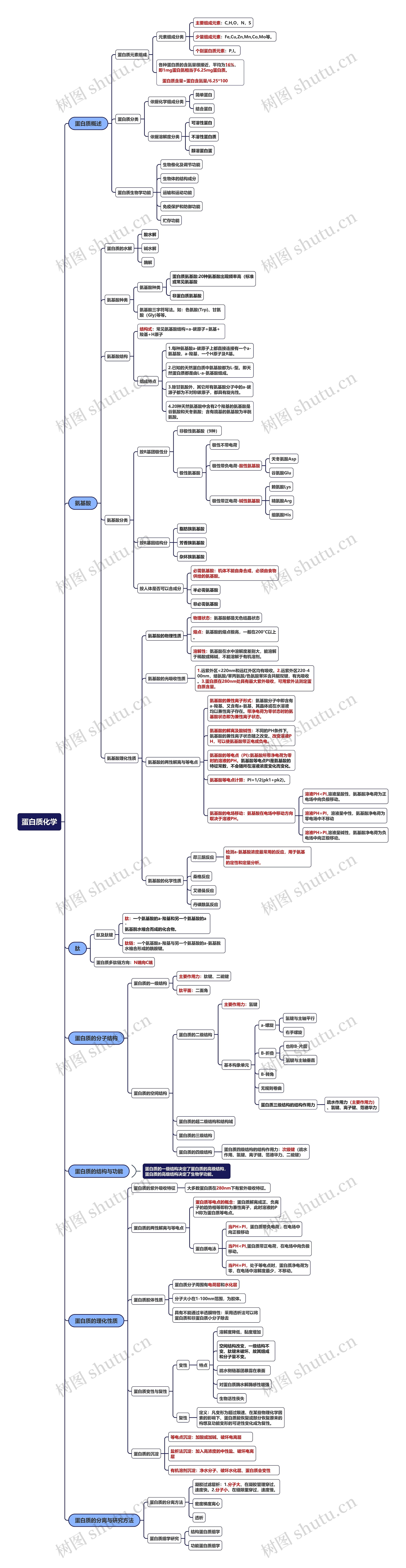
蛋白质概述
蛋白质元素组成
元素组成分类
主要组成元素:C,H,O,N,S
少量组成元素:Fe,Cu,Zn,Mn,Co,Mo等。
个别蛋白质元素:P,I。
各种蛋白质的含氮量很接近,平均为16%, 即1mg蛋白氮相当于6.25mg蛋白质。 蛋白质含量=蛋白含氮量/6.25*100
蛋白质分类
依据化学组成分类
简单蛋白
结合蛋白
依据溶解度分类
可溶性蛋白
不溶性蛋白质
醇溶蛋白蛋
蛋白质生物学功能
生物倠化及调节功能
生物体的结构成分
运输和运动功能
免疫保护和防御功能
贮存功能
氨基酸
蛋白质的水解
酸水解
碱水解
酶解
氨基酸种类
氨基酸种类
蛋白质氨基酸:20种氨基酸出现频率高(标准 或常见氨基酸
非蛋白质氨基酸
氨基酸三字符写法。如:色氨酸(Trp)、甘氨酸(Gly)等等。
氨基酸结构
结构式:常见氨基酸结构=a-碳原子+氨基+羧基+H原子
组成特点
1.每种氨基酸a-碳原子上都直接连接有一个a-氨基酸,a-羧基,一个H原子及R基。
2.已知的天然蛋白质中氨基酸都为L-型。即天然蛋白质都是由L-a-氨基酸组成。
3.除甘氨酸外,其它所有氨基酸分子中的a-碳 源子都为不对称碳原子,都具有旋光性。
4.20种天然氨基酸中含有2个羧基的氨基酸是谷氨酸和天冬氨酸;含有疏基的氨基酸为半胱氨酸。
氨基酸分类
按R基团极性分
非极性氨基酸(9种)
极性氨基酸
极性不带电荷
极性带负电荷-酸性氨基酸
天冬氨酸Asp
谷氨酸Glu
极性带正电荷-碱性氨基酸
赖氨酸Lys
精氨酸Arg
组氨酸His
按R基因结构分
脂肪族氨基酸
芳香族氨基酸
杂环族氨基酸
按人体是否可以合成分
必需氨基酸:机体不能自身合成,必须由食物 供给的氨基酸。
半必需氨基酸
非必需氨基酸
氨基酸理化性质
氨基酸的物理性质
物理状态:氨基酸都是无色结晶状态
熔点:氨基酸的熔点极高,一般在200°C以上。
溶解性:氨基酸在水中溶解度差别大,能溶解于稀酸或稀碱,不能溶解于有机溶剂。
氨基酸的光吸收性质
1.远紫外区<220nm和远红外区均有吸收。2.远紫外区220-4 00nm,络氨酸/苯丙氨酸/色氨酸苯环含共轭双键,有光吸收 。3.蛋白质在280nm处具有最大紫外吸收,可用紫外法测定蛋白质含量。
氨基酸的两性解离与等电点
氨基酸的兼性离子形式:氨基酸分子中即含有a-羧基、又含有a-氨基,其晶体或在水溶液均以兼性离子存在。带净电荷为零状态时的氨基酸状态即为兼性离子状态。
氨基酸的解离及酸碱性:不同的PH条件下,氨基酸的兼性离子状态随之改变。改变溶液PH,可以使氨基酸带正电或负电。
氨基酸的等电点(PI):氨基酸所带净电荷为零时的溶液的PH。氨基酸等电点PI是氨基酸的特征常数,不会随所在溶液浓度变化而变化。
氨基酸等电点计算:PI=1/2(pk1+pk2)。
氨基酸的电场移动:氨基酸在电场中移动方向取决于溶液PH。
溶液PH<PI,溶液呈酸性,氨基酸净电荷为正 电场中向负极移动。
溶液PH=PI,溶液呈中性,氨基酸净电荷为 零电场中不移动
溶液PH>PI,溶液呈碱性,氨基酸净电荷为负 电场中向正极移动。
氨基酸的化学性质
茚三酮反应
检测a-氨基酸浓度最常用的反应,用于氨基酸 的定性和定量分析。
桑格反应
艾德曼反应
丹磺酰氯反应
肽
肽及肽键
肽:一个氨基酸的a-羧基和另一个氨基酸的a- 氨基脱水缩合而成的化合物。
肽链:一个氨基酸a-羧基与另一个氨基酸的a-氨基脱水缩合形成的酰胺键。
蛋白质多肽链方向:N端向C端
蛋白质的分子结构
蛋白质的一级结构
主要作用力:肽键、二硫键
肽平面:二面角
蛋白质的空间结构
蛋白质的二级结构
主要作用力:氢键
基本构象单元
a-螺旋
氢键与主轴平行
右手螺旋
B-折叠
也称B-片层
氢键与主轴垂直
B-转角
无规则卷曲
蛋白质三级结构的结构作用力
疏水作用力(主要作用力)、氢键、离子键、范德华力
蛋白质的超二级结构和结构域
蛋白质的三级结构
蛋白质的四级结构
蛋白质四级结构的结构作用力:次级键(疏水作用、氢键、离子键、范德华力、二硫键)
蛋白质的结构与功能
蛋白质的理化性质
蛋白质的紫外吸收特征
大多数蛋白质在280nm下有紫外吸收特征。
蛋白质的两性解离与等电点
蛋白质等电点的概念:蛋白质解离成正、负离子的趋势相等即称为兼性离子,此时溶液的PH称为蛋白质等电点。
蛋白质电泳
当PH>PI,蛋白质带负电荷,在电场中 向正极移动
当PH<PI,蛋白质带正电荷,在电场中向负极 移动。
当PH=PI,处于等电点时,蛋白质净电荷为 零,在电场中溶解度最少,不移动。
蛋白质胶体性质
蛋白质分子周围有电荷层和水化层
分子大小在1-100nm范围,为胶体。
具有不能通过半透膜特性:采用透析法可以将蛋白质和非蛋白质小分子除去
蛋白质变性与复性
变性
特点
溶解度降低,黏度增加
空间结构改变,一级结构不变、肽键未破坏、故其组成和分子量不变。
疏水侧链基团暴露在表面
对蛋白质酶水解酶感性增强
生物活性丧失
复性
定义:凡变形为超过限速、在某些物理化学因素的影响下、蛋白质能恢复或部分恢复原来的构想及功能变形的可逆性变化成为复性。
蛋白质的沉淀
等电点沉淀:加酸或加碱、破坏电离层
盐析法沉淀:加入高浓度的中性盐、破坏电离层
有机溶剂沉淀:净水分子、破坏水化层、蛋白质会变性
蛋白质的分离与研究方法
蛋白质的分离方法
凝胶过滤层析:1.分子大、在凝胶管理穿过、 速度快。2.分子小、在缝隙里穿过,速度慢。
密度梯度离心
透析
蛋白质组学研究
结构蛋白质组学
功能蛋白质组学
蛋白质的一级结构决定了蛋白质的高级结构,蛋白质的高级结构决定了生物学功能。思维导图模板大纲
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096


树图思维导图提供 生化第二章 在线思维导图免费制作,点击“编辑”按钮,可对 生化第二章 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:90ed30dd97ddf19328c0bb40a61b6e11








 上海工商
上海工商