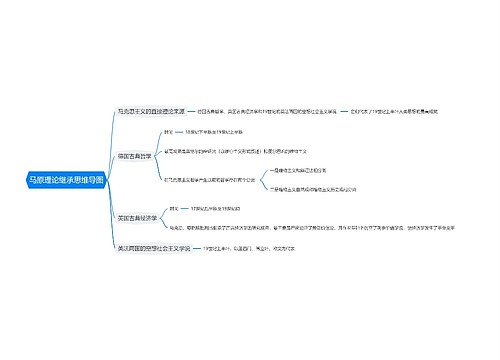
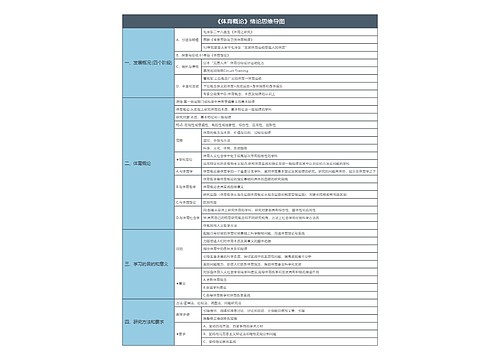
《分析化学》第三章 滴定分析法概论 思维导图
化学计量点:滴定剂的量与被测物质的量正好符合化学反应式所表示的计量关系的一点。
树图思维导图提供 《分析化学》第三章 滴定分析法概论 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第三章 滴定分析法概论 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:49306b6a23a9d268f46308f10d62e00e
思维导图大纲
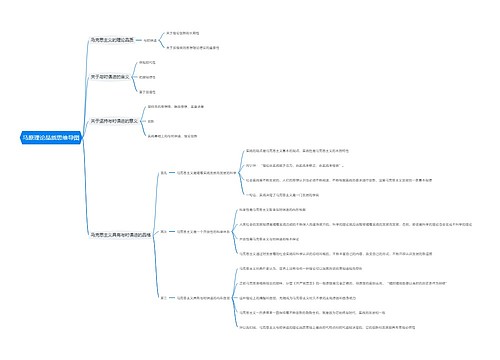
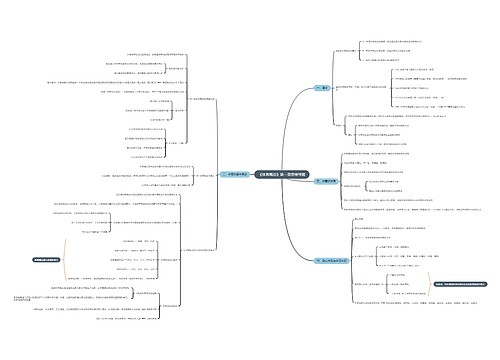
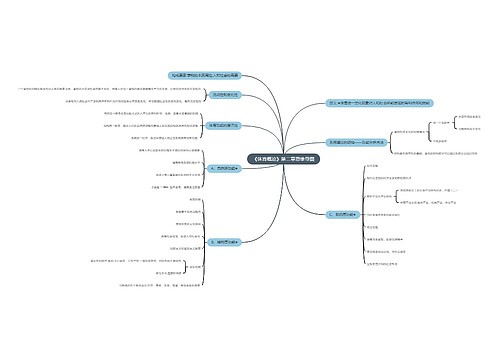
《分析化学》第三章 滴定分析法概论 思维导图模板大纲
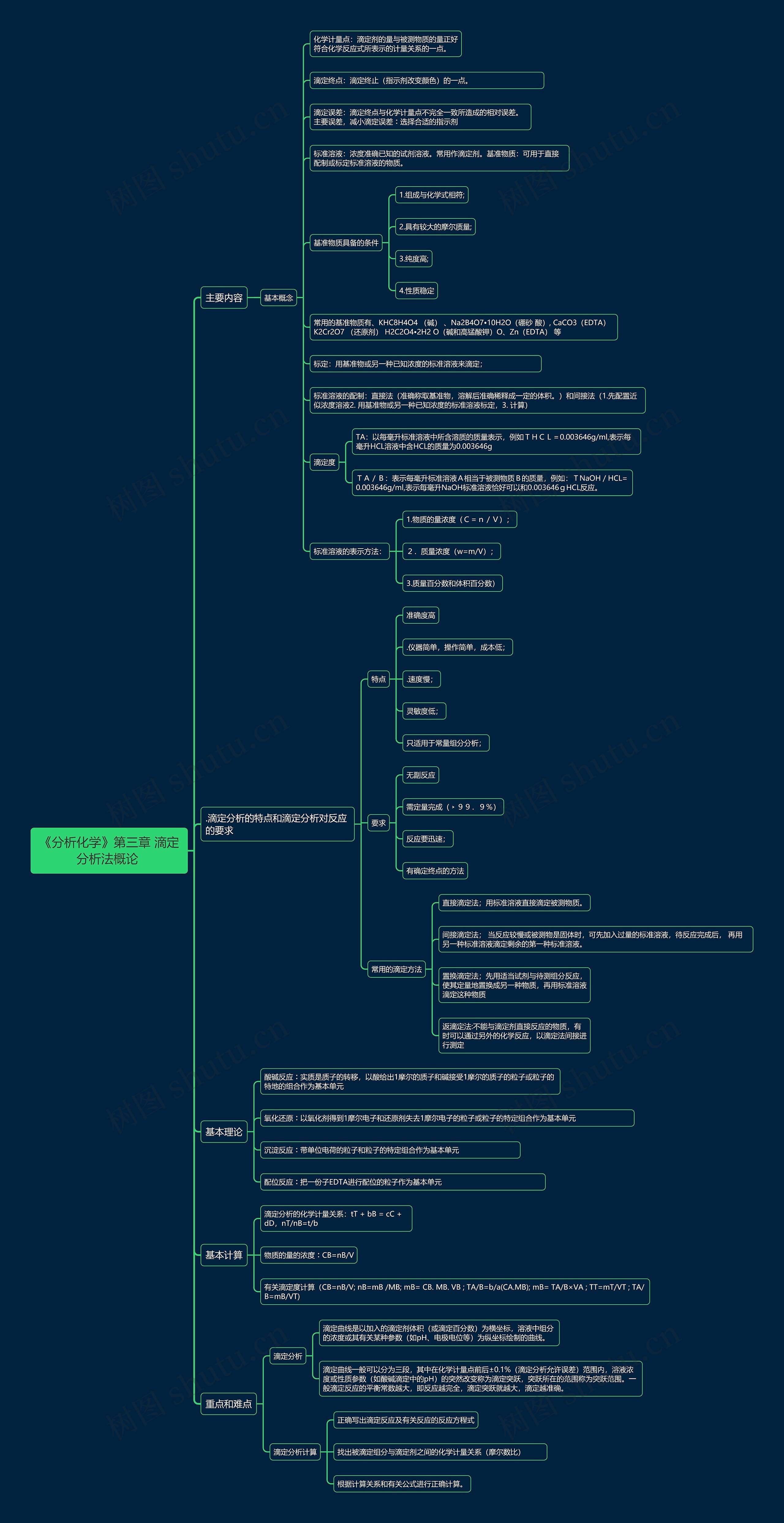
主要内容
基本概念
化学计量点:滴定剂的量与被测物质的量正好符合化学反应式所表示的计量关系的一点。
滴定终点:滴定终止(指示剂改变颜色)的一点。
滴定误差:滴定终点与化学计量点不完全一致所造成的相对误差。主要误差,减小滴定误差︰选择合适的指示剂
标准溶液:浓度准确已知的试剂溶液。常用作滴定剂。基准物质:可用于直接配制或标定标准溶液的物质。
基准物质具备的条件
1.组成与化学式相符;
2.具有较大的摩尔质量;
3.纯度高;
4.性质稳定
常用的基准物质有、KHC8H4O4 (碱) 、Na2B4O7•10H2O(硼砂 酸), CaCO3(EDTA) K2Cr2O7 (还原剂) H2C2O4•2H2 O(碱和高锰酸钾)O、Zn(EDTA) 等
标定:用基准物或另一种已知浓度的标准溶液来滴定;
标准溶液的配制:直接法(准确称取基准物,溶解后准确稀释成一定的体积。)和间接法(1.先配置近似浓度溶液2. 用基准物或另一种已知浓度的标准溶液标定,3. 计算)
滴定度
TA:以每毫升标准溶液中所含溶质的质量表示,例如THCL=0.003646g/ml,表示每毫升HCL溶液中含HCL的质量为0.003646g
TA/B:表示每毫升标准溶液A相当于被测物质B的质量,例如:TNaOH/HCL=0.003646g/ml,表示每毫升NaOH标准溶液恰好可以和0.003646gHCL反应。
标准溶液的表示方法:
1.物质的量浓度(C=n/V);
2.质量浓度(w=m/V);
3.质量百分数和体积百分数)
.滴定分析的特点和滴定分析对反应的要求
特点
准确度高
.仪器简单,操作简单,成本低;
.速度慢;
灵敏度低;
只适用于常量组分分析;
要求
无副反应
需定量完成(﹥99.9%)
反应要迅速;
有确定终点的方法
常用的滴定方法
直接滴定法;用标准溶液直接滴定被测物质。
间接滴定法; 当反应较慢或被测物是固体时,可先加入过量的标准溶液,待反应完成后, 再用另一种标准溶液滴定剩余的第一种标准溶液。
置换滴定法;先用适当试剂与待测组分反应,使其定量地置换成另一种物质,再用标准溶液滴定这种物质
返滴定法:不能与滴定剂直接反应的物质,有时可以通过另外的化学反应,以滴定法间接进行测定
基本理论
酸碱反应︰实质是质子的转移,以酸给出1摩尔的质子和碱接受1摩尔的质子的粒子或粒子的特地的组合作为基本单元
氧化还原︰以氧化剂得到1摩尔电子和还原剂失去1摩尔电子的粒子或粒子的特定组合作为基本单元
沉淀反应︰带单位电荷的粒子和粒子的特定组合作为基本单元
配位反应︰把一份子EDTA进行配位的粒子作为基本单元
基本计算
滴定分析的化学计量关系:tT + bB = cC + dD,nT/nB=t/b
物质的量的浓度︰CB=nB/V
有关滴定度计算(CB=nB/V; nB=mB /MB; mB= CB. MB. VB ; TA/B=b/a(CA.MB); mB= TA/B×VA ; TT=mT/VT ; TA/B=mB/VT)
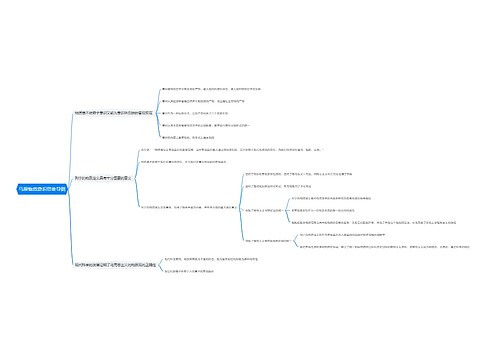
重点和难点
滴定分析
滴定曲线是以加入的滴定剂体积(或滴定百分数)为横坐标,溶液中组分的浓度或其有关某种参数(如pH、电极电位等)为纵坐标绘制的曲线。
滴定曲线一般可以分为三段,其中在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液浓度或性质参数(如酸碱滴定中的pH)的突然改变称为滴定突跃,突跃所在的范围称为突跃范围。一般滴定反应的平衡常数越大,即反应越完全,滴定突跃就越大,滴定越准确。
滴定分析计算
正确写出滴定反应及有关反应的反应方程式
找出被滴定组分与滴定剂之间的化学计量关系(摩尔数比)
根据计算关系和有关公式进行正确计算。
相关思维导图模板


树图思维导图提供 《分析化学》第十五章 质谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十五章 质谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:250c732e063fa8626ea4de0f1a4438cb

树图思维导图提供 《分析化学》第十四章 核磁共振波谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十四章 核磁共振波谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:30a2a9bee0d68ad655ade9793eab99e2






 上海工商
上海工商