《分析化学》第六章 配位滴定法思维导图
EDTA的性质(1) EDTA:白色无水结晶粉末,难溶于水(0.02g/100mL),易溶于氨水和氢氧化纳溶液中。(不适合作标液)
树图思维导图提供 《分析化学》第六章 配位滴定法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第六章 配位滴定法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:cbf5400aa0fa1c43df40627322ace989
思维导图大纲
《分析化学》第六章 配位滴定法思维导图模板大纲
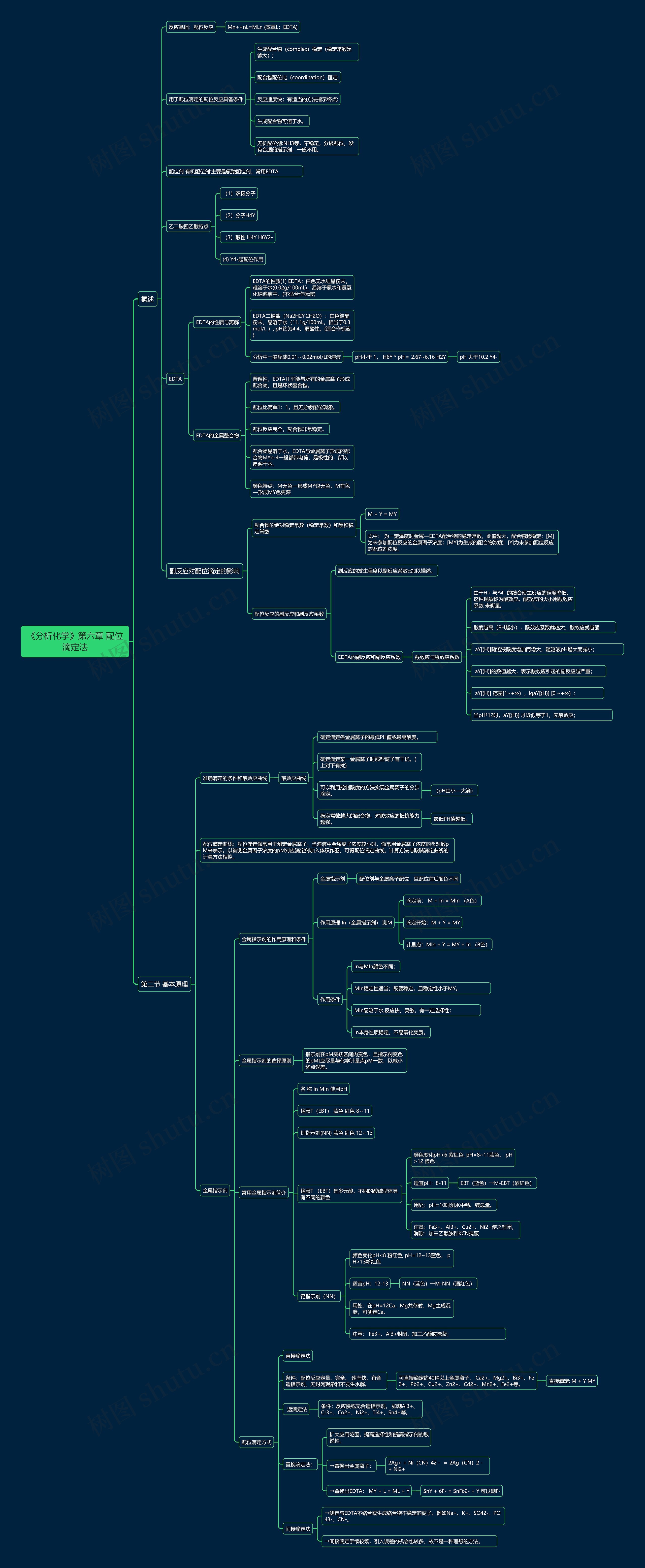
概述
反应基础:配位反应
Mn++nL=MLn (本章L:EDTA)
用于配位滴定的配位反应具备条件
生成配合物(complex)稳定(稳定常数足够大);
配合物配位比(coordination)恒定;
反应速度快;有适当的方法指示终点;
生成配合物可溶于水。
无机配位剂:NH3等,不稳定,分级配位,没有合适的指示剂,一般不用。
配位剂 有机配位剂:主要是氨羧配位剂,常用EDTA
乙二胺四乙酸特点
(1)双极分子
(2)分子H4Y
(3)酸性 H4Y H6Y2-
(4) Y4-起配位作用
EDTA
EDTA的性质与离解
EDTA的性质(1) EDTA:白色无水结晶粉末,难溶于水(0.02g/100mL),易溶于氨水和氢氧化纳溶液中。(不适合作标液)
EDTA二钠盐(Na2H2Y·2H2O):白色结晶粉末,易溶于水(11.1g/100mL,相当于0.3mol/L ), pH约为4.4,弱酸性。(适合作标液)
分析中一般配成0.01~0.02mol/L的溶液
pH小于 1, H6Y * pH= 2.67~6.16 H2Y
pH 大于10.2 Y4-
EDTA的金属螯合物
普遍性,EDTA几乎能与所有的金属离子形成配合物,且是环状螯合物。
配位比简单1:1,且无分级配位现象。
配位反应完全,配合物非常稳定。
配合物易溶于水。EDTA与金属离子形成的配合物MYn-4一般都带电荷,是极性的,所以易溶于水。
颜色特点:M无色—形成MY也无色,M有色—形成MY色更深
副反应对配位滴定的影响
配合物的绝对稳定常数(稳定常数)和累积稳定常数
M + Y = MY
式中: 为一定温度时金属—EDTA配合物的稳定常数,此值越大,配合物越稳定;[M]为未参加配位反应的金属离子浓度;[MY]为生成的配合物浓度;[Y]为未参加配位反应的配位剂浓度。
配位反应的副反应和副反应系数
副反应的发生程度以副反应系数α加以描述。
EDTA的副反应和副反应系数
酸效应与酸效应系数
由于H+ 与Y4- 的结合使主反应的程度降低,这种现象称为酸效应。酸效应的大小用酸效应系数 来衡量。
酸度越高(PH越小),酸效应系数就越大,酸效应就越强
aY[(H)]随溶液酸度增加而增大,随溶液pH增大而减小;
aY[(H)]的数值越大,表示酸效应引起的副反应越严重;
aY[(H)] 范围[1~+∞),lgaY[(H)] [0 ~+∞);
当pH³12时,aY[(H)] 才近似等于1,无酸效应;
第二节 基本原理
准确滴定的条件和酸效应曲线
酸效应曲线
确定滴定各金属离子的最低PH值或最高酸度。
确定滴定某一金属离子时那些离子有干扰。(上对下有扰)
可以利用控制酸度的方法实现金属离子的分步滴定。
(pH由小—大滴)
稳定常数越大的配合物,对酸效应的抵抗能力越强,
最低PH值越低。
配位滴定曲线:配位滴定通常用于测定金属离子,当溶液中金属离子浓度较小时,通常用金属离子浓度的负对数pM来表示。以被测金属离子浓度的pM对应滴定剂加入体积作图,可得配位滴定曲线。计算方法与酸碱滴定曲线的计算方法相似。
金属指示剂
金属指示剂的作用原理和条件
金属指示剂
配位剂与金属离子配位,且配位前后颜色不同
作用原理 In(金属指示剂) 测M
滴定前: M + In = MIn (A色)
滴定开始:M + Y = MY
计量点:MIn + Y = MY + In (B色)
作用条件
In与MIn颜色不同;
MIn稳定性适当;既要稳定,且稳定性小于MY。
MIn易溶于水,反应快,灵敏,有一定选择性;
In本身性质稳定,不易氧化变质。
金属指示剂的选择原则
指示剂在pM突跃区间内变色,且指示剂变色的pMt应尽量与化学计量点pM一致,以减小终点误差。
常用金属指示剂简介
名 称 In MIn 使用pH
铬黑T(EBT) 蓝色 红色 8~11
钙指示剂(NN) 蓝色 红色 12~13
铬黑T (EBT)是多元酸,不同的酸碱型体具有不同的颜色
颜色变化pH<6 紫红色, pH=8~11蓝色, pH>12 橙色
适宜pH:8-11
EBT(蓝色)→M-EBT(酒红色)
用处:pH=10时测水中钙、镁总量。
注意:Fe3+、Al3+、Cu2+、Ni2+使之封闭,消除:加三乙醇胺和KCN掩蔽
钙指示剂(NN)
颜色变化pH<8 粉红色, pH=12~13蓝色, pH>13粉红色
适宜pH:12-13
NN(蓝色)→M-NN(酒红色)
用处:在pH=12Ca,Mg共存时,Mg生成沉淀,可测定Ca。
注意: Fe3+、Al3+封闭,加三乙醇胺掩蔽;
配位滴定方式
直接滴定法
条件:配位反应定量、完全、 速率快、有合适指示剂、无封闭现象和不发生水解。
可直接滴定约40种以上金属离子, Ca2+、Mg2+、Bi3+、Fe3+、Pb2+、Cu2+、Zn2+、Cd2+、Mn2+、Fe2+等。
直接滴定: M + Y MY
返滴定法
条件:反应慢或无合适指示剂, 如测Al3+、Cr3+、Co2+、Ni2+、Ti4+、Sn4+等。
置换滴定法:
扩大应用范围,提高选择性和提高指示剂的敏锐性。
→置换出金属离子:
2Ag+ + Ni(CN)42- = 2Ag(CN)2-+ Ni2+
→置换出EDTA: MY + L = ML + Y
SnY + 6F- = SnF62- + Y 可以测F-
间接滴定法
→测定与EDTA不络合或生成络合物不稳定的离子。例如Na+、K+、SO42-、PO43-、CN-。
→间接滴定手续较繁,引入误差的机会也较多,故不是一种理想的方法。
相关思维导图模板


树图思维导图提供 《分析化学》第十五章 质谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十五章 质谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:250c732e063fa8626ea4de0f1a4438cb

树图思维导图提供 《分析化学》第十四章 核磁共振波谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十四章 核磁共振波谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:30a2a9bee0d68ad655ade9793eab99e2










 上海工商
上海工商