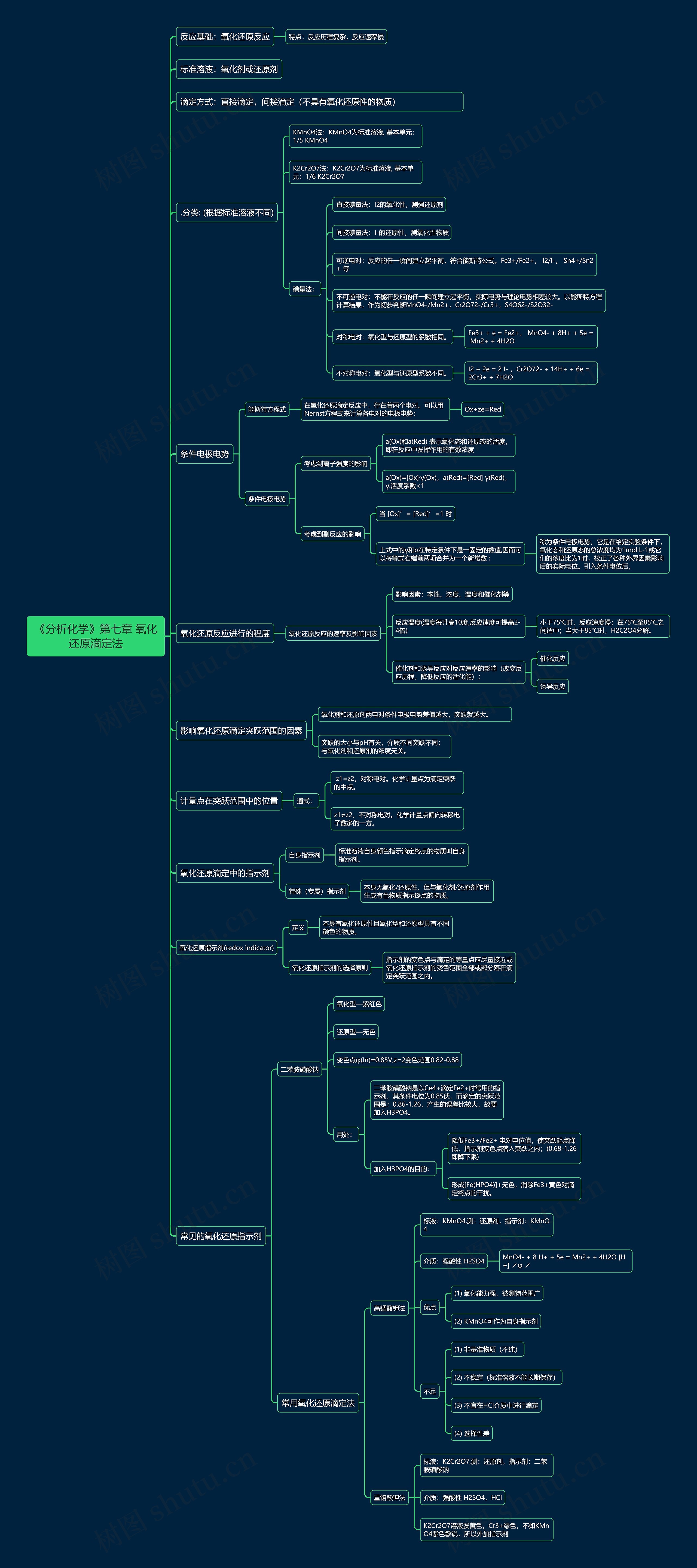
《分析化学》第七章 氧化还原滴定法思维导图
不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势与理论电势相差较大。以能斯特方程计算结果,作为初步判断MnO4-/Mn2+,Cr2O72-/Cr3+,S4O62-/S2O32-
树图思维导图提供 《分析化学》第七章 氧化还原滴定法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第七章 氧化还原滴定法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:63a2c7825662e0575a6f2f406b315e00
思维导图大纲
《分析化学》第七章 氧化还原滴定法思维导图模板大纲
反应基础:氧化还原反应
特点:反应历程复杂,反应速率慢
标准溶液:氧化剂或还原剂
滴定方式:直接滴定,间接滴定(不具有氧化还原性的物质)
.分类: (根据标准溶液不同)
KMnO4法:KMnO4为标准溶液, 基本单元:1/5 KMnO4
K2Cr2O7法:K2Cr2O7为标准溶液, 基本单元:1/6 K2Cr2O7
碘量法:
直接碘量法:I2的氧化性,测强还原剂
间接碘量法:I-的还原性,测氧化性物质
可逆电对:反应的任一瞬间建立起平衡,符合能斯特公式。Fe3+/Fe2+, I2/I-, Sn4+/Sn2+ 等
不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势与理论电势相差较大。以能斯特方程计算结果,作为初步判断MnO4-/Mn2+,Cr2O72-/Cr3+,S4O62-/S2O32-
对称电对:氧化型与还原型的系数相同。
Fe3+ + e = Fe2+, MnO4- + 8H+ + 5e = Mn2+ + 4H2O
不对称电对:氧化型与还原型系数不同。
I2 + 2e = 2 I- ,Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O
条件电极电势
能斯特方程式
在氧化还原滴定反应中,存在着两个电对。可以用Nernst方程式来计算各电对的电极电势:
Ox+ze=Red
条件电极电势
考虑到离子强度的影响
a(Ox)和a(Red) 表示氧化态和还原态的活度,即在反应中发挥作用的有效浓度
a(Ox)=[Ox]·γ(Ox),a(Red)=[Red] γ(Red),γ:活度系数<1
考虑到副反应的影响
当 [Ox]’= [Red]’=1 时
上式中的γ和α在特定条件下是一固定的数值,因而可以将等式右端前两项合并为一个新常数 :
称为条件电极电势,它是在给定实验条件下,氧化态和还原态的总浓度均为1mol·L-1或它们的浓度比为1时,校正了各种外界因素影响后的实际电位。引入条件电位后,
氧化还原反应进行的程度
氧化还原反应的速率及影响因素
影响因素:本性、浓度、温度和催化剂等
反应温度(温度每升高10度,反应速度可提高2-4倍)
小于75℃时,反应速度慢;在75℃至85℃之间适中;当大于85℃时,H2C2O4分解。
催化剂和诱导反应对反应速率的影响(改变反应历程,降低反应的活化能);
催化反应
诱导反应
影响氧化还原滴定突跃范围的因素
氧化剂和还原剂两电对条件电极电势差值越大,突跃就越大。
突跃的大小与pH有关,介质不同突跃不同;与氧化剂和还原剂的浓度无关。
计量点在突跃范围中的位置
通式:
z1=z2,对称电对。化学计量点为滴定突跃的中点。
z1≠z2,不对称电对。化学计量点偏向转移电子数多的一方。
氧化还原滴定中的指示剂
自身指示剂
标准溶液自身颜色指示滴定终点的物质叫自身指示剂。
特殊(专属)指示剂
本身无氧化/还原性,但与氧化剂/还原剂作用生成有色物质指示终点的物质。
氧化还原指示剂(redox indicator)
定义
本身有氧化还原性且氧化型和还原型具有不同颜色的物质。
氧化还原指示剂的选择原则
指示剂的变色点与滴定的等量点应尽量接近或氧化还原指示剂的变色范围全部或部分落在滴定突跃范围之内。
常见的氧化还原指示剂
二苯胺磺酸钠
氧化型—紫红色
还原型—无色
变色点φ(In)=0.85V,z=2变色范围0.82-0.88
用处:
二苯胺磺酸钠是以Ce4+滴定Fe2+时常用的指示剂,其条件电位为0.85伏,而滴定的突跃范围是:0.86-1.26,产生的误差比较大,故要加入H3PO4。
加入H3PO4的目的:
降低Fe3+/Fe2+ 电对电位值,使突跃起点降低,指示剂变色点落入突跃之内;(0.68-1.26即降下限)
形成[Fe(HPO4)]+无色,消除Fe3+黄色对滴定终点的干扰。
常用氧化还原滴定法
高锰酸钾法
标液:KMnO4,测:还原剂,指示剂:KMnO4
介质:强酸性 H2SO4
MnO4- + 8 H+ + 5e = Mn2+ + 4H2O [H+] ↗φ ↗
优点
(1) 氧化能力强,被测物范围广
(2) KMnO4可作为自身指示剂
不足
(1) 非基准物质(不纯)
(2) 不稳定(标准溶液不能长期保存)
(3) 不宜在HCl介质中进行滴定
(4) 选择性差
重铬酸钾法
标液:K2Cr2O7,测:还原剂,指示剂:二苯胺磺酸钠
介质:强酸性 H2SO4,HCI
K2Cr2O7溶液发黄色,Cr3+绿色,不如KMnO4紫色敏锐,所以外加指示剂
相关思维导图模板


树图思维导图提供 《分析化学》第十五章 质谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十五章 质谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:250c732e063fa8626ea4de0f1a4438cb

树图思维导图提供 《分析化学》第十四章 核磁共振波谱法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》第十四章 核磁共振波谱法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:30a2a9bee0d68ad655ade9793eab99e2












 上海工商
上海工商