药品不良反应报告和监测管理思维导图
对药品不良反应报告和监测管理的概述
树图思维导图提供 药品不良反应报告和监测管理 在线思维导图免费制作,点击“编辑”按钮,可对 药品不良反应报告和监测管理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:9748cfc705dc0c0fce23a7f6c9d9aa70
思维导图大纲
药品不良反应报告和监测管理思维导图模板大纲
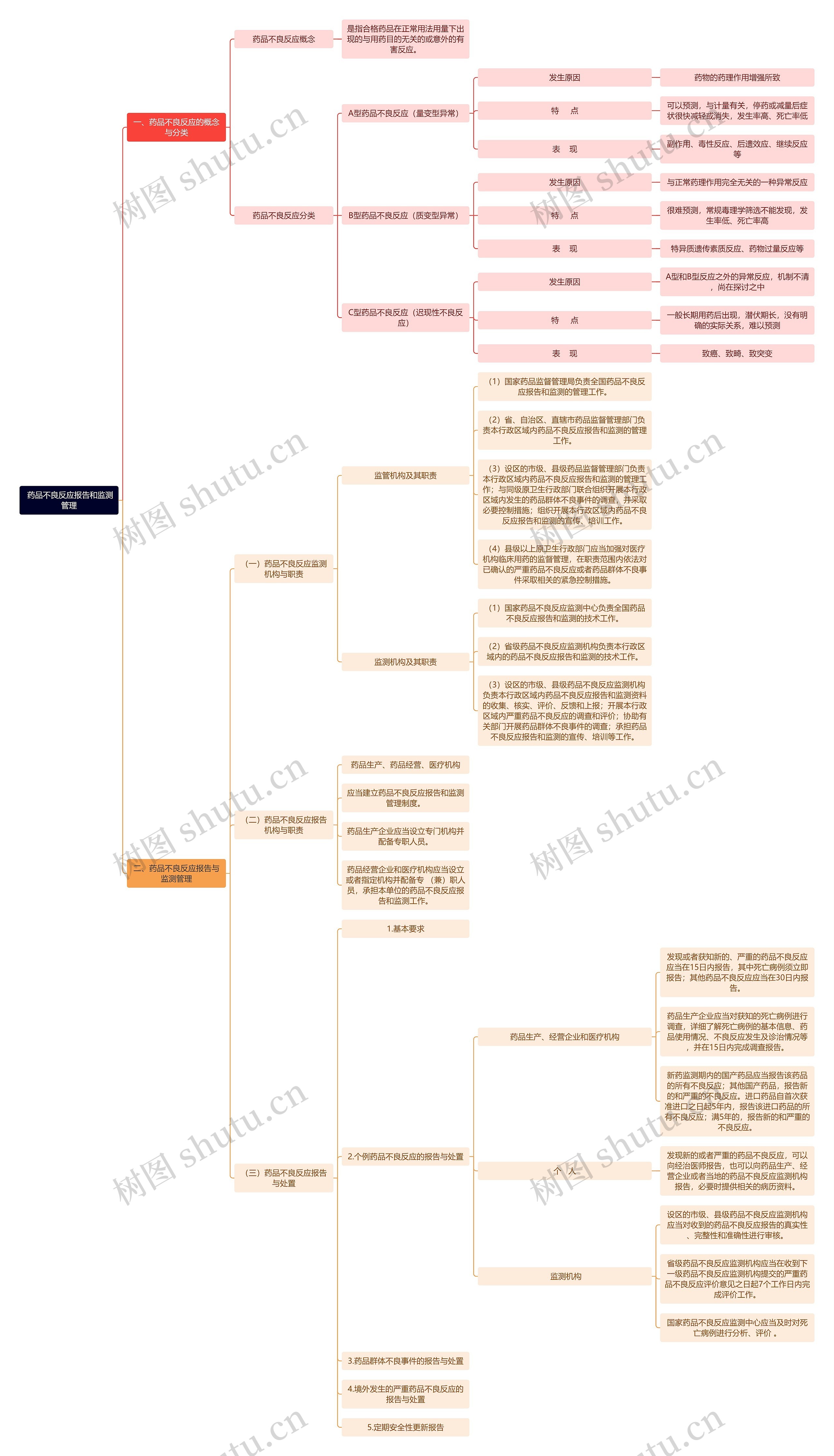
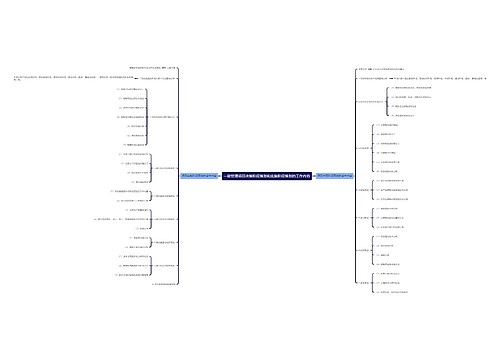
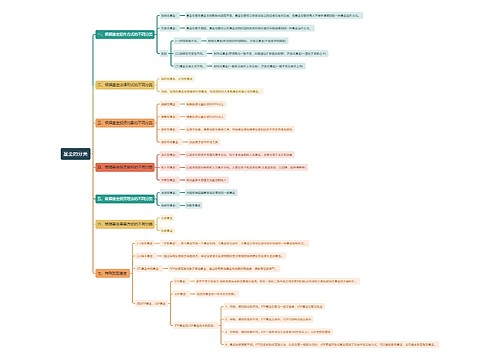
一、药品不良反应的概念与分类
药品不良反应概念
是指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。
药品不良反应分类
A型药品不良反应(量变型异常)
发生原因
药物的药理作用增强所致
特 点
可以预测,与计量有关,停药或减量后症状很快减轻或消失,发生率高、死亡率低
表 现
副作用、毒性反应、后遗效应、继续反应等
B型药品不良反应(质变型异常)
发生原因
与正常药理作用完全无关的一种异常反应
特 点
很难预测,常规毒理学筛选不能发现,发生率低、死亡率高
表 现
特异质遗传素质反应、药物过量反应等
C型药品不良反应(迟现性不良反应)
发生原因
A型和B型反应之外的异常反应,机制不清,尚在探讨之中
特 点
一般长期用药后出现,潜伏期长,没有明确的实际关系,难以预测
表 现
致癌、致畸、致突变
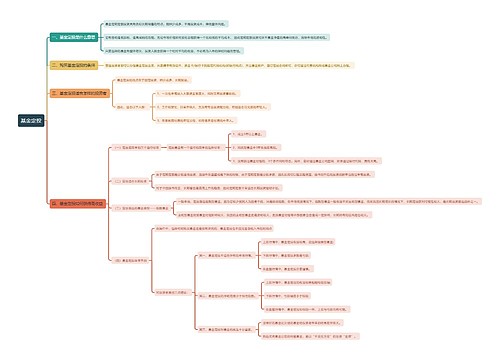
二、药品不良反应报告与监测管理
(一)药品不良反应监测机构与职责
监管机构及其职责
(1)国家药品监督管理局负责全国药品不良反应报告和监测的管理工作。
(2)省、自治区、直辖市药品监督管理部门负责本行政区域内药品不良反应报告和监测的管理工作。
(3)设区的市级、县级药品监督管理部门负责本行政区域内药品不良反应报告和监测的管理工作;与同级原卫生行政部门联合组织开展本行政区域内发生的药品群体不良事件的调查,并采取必要控制措施;组织开展本行政区域内药品不良反应报告和监测的宣传、培训工作。
(4)县级以上原卫生行政部门应当加强对医疗机构临床用药的监督管理,在职责范围内依法对已确认的严重药品不良反应或者药品群体不良事件采取相关的紧急控制措施。
监测机构及其职责
(1)国家药品不良反应监测中心负责全国药品不良反应报告和监测的技术工作。
(2)省级药品不良反应监测机构负责本行政区域内的药品不良反应报告和监测的技术工作。
(3)设区的市级、县级药品不良反应监测机构负责本行政区域内药品不良反应报告和监测资料的收集、核实、评价、反馈和上报;开展本行政区域内严重药品不良反应的调查和评价;协助有关部门开展药品群体不良事件的调查;承担药品不良反应报告和监测的宣传、培训等工作。
(二)药品不良反应报告机构与职责
药品生产、药品经营、医疗机构
应当建立药品不良反应报告和监测管理制度。
药品生产企业应当设立专门机构并配备专职人员。
药品经营企业和医疗机构应当设立或者指定机构并配备专 (兼)职人员,承担本单位的药品不良反应报告和监测工作。
(三)药品不良反应报告与处置
1.基本要求
2.个例药品不良反应的报告与处置
药品生产、经营企业和医疗机构
发现或者获知新的、严重的药品不良反应应当在15日内报告,其中死亡病例须立即报告;其他药品不良反应应当在30日内报告。
药品生产企业应当对获知的死亡病例进行调查,详细了解死亡病例的基本信息、药品使用情况、不良反应发生及诊治情况等,并在15日内完成调查报告。
新药监测期内的国产药品应当报告该药品的所有不良反应;其他国产药品,报告新的和严重的不良反应。进口药品自首次获准进口之日起5年内,报告该进口药品的所有不良反应;满5年的,报告新的和严重的不良反应。
个 人
发现新的或者严重的药品不良反应,可以向经治医师报告,也可以向药品生产、经营企业或者当地的药品不良反应监测机构报告,必要时提供相关的病历资料。
监测机构
设区的市级、县级药品不良反应监测机构应当对收到的药品不良反应报告的真实性、完整性和准确性进行审核。
省级药品不良反应监测机构应当在收到下一级药品不良反应监测机构提交的严重药品不良反应评价意见之日起7个工作日内完成评价工作。
国家药品不良反应监测中心应当及时对死亡病例进行分析、评价 。
3.药品群体不良事件的报告与处置
4.境外发生的严重药品不良反应的报告与处置
5.定期安全性更新报告
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 数智技术在工程设备管理中的应用 在线思维导图免费制作,点击“编辑”按钮,可对 数智技术在工程设备管理中的应用 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9a2de84ad9a9ceebc96385d71be9ebe




 上海工商
上海工商