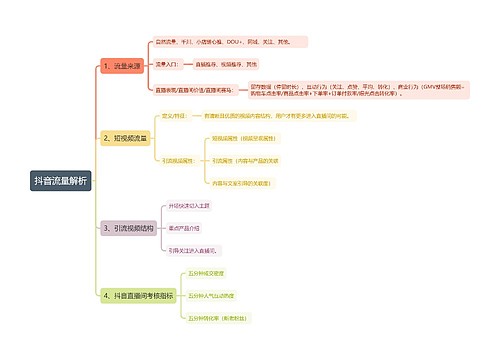
烷烃和环烷烃思维导图

烷烃和环烷烃的构象,物理性质,来源等内容讲解
树图思维导图提供 烷烃和环烷烃 在线思维导图免费制作,点击“编辑”按钮,可对 烷烃和环烷烃 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:529ba9a1139e1a4ea81b2ce6e5d98c1c
思维导图大纲
烷烃和环烷烃思维导图模板大纲
1.烷经和环烷烃的构造异构
分子式相同,分子构造不同的化合物,称为构造异构体。
这类同分异构体是由于分子内原子间相互键连的顺序(即构造)不同造成的。
正丁烷和2﹣甲基丙烷、环丁烷和甲基环丙烷都属于同分异构体中的构造异构体。这类构造异构体是由于碳骨架不同引起的,故又称碳架异构。烷烃和环烷烃的构造异构均属于碳架异构。
环烷烃的构造异构现象与烷烃相似,但比烷烃复杂。例如,含有五个碳原子的环烷烃(C5H10)比烷烃(C,H2)的构造异构体多。异构现象是造成有机化合物数量庞大的原因之一。
2.烷烃和环烷烃的命名
伯、仲、叔、季碳原子和伯、仲、叔氢原子
当分子中的某一饱和碳原子与一个、两个、三个或四个碳原子相连时,该碳原子分别称为伯、仲、叔、季碳原子,也称为一级、二级、三级、四级碳原子,常分别用1,2,3,4°表示。与伯、仲、叔碳原子相连的氢原子,分别称为伯、仲、叔氢原子。
烷烃的命名
"正"代表直链烷烃;"异"指仅在一末端具有(CH2)2CH一构造而无其他支链的烷烃;"新"一般指具有(CH2)3C一构造的含五六个碳原子的烷烃。
烷基与环烷基
第一种方式是以游离价键的碳原子为起点,选取取代基中最长碳链为取代基母体,并给予该原子编号1,且编号1常被省略;取代基母体上的支链被认为是取代基,并赋予相应的编号。确定取代基母体的英文名称时,使用后缀﹣yl代替相应烷烃的﹣ane后缀。例如,异丁基按此方法可命名为2﹣二甲基丙基(2-methylpropyl)。又如,叔丁基可命名为1,1﹣二甲基乙基(1,1-dimethylethyl)。此方法更适用于取代基的游离价键碳原子为伯碳原子的情况。
第二种方式是选取包含游离价键碳原子的最长碳链为取代基母体,编号时,从碳链末端开始,并给予游离价键碳原子尽可能小的编号,命名时在后缀"基"前加位次的编号,母体上的支链作为取代基。在英文名称中,使用﹣yl后缀代替烷烃母体后缀﹣ane中的"e",并在取代基母体与后缀之间加入编号,以"一"分隔。例如,叔丁基按此方法可命名为2-甲基丙﹣2﹣基,英文命名为2-methylpropan-2-yl。 考虑到命名方法与教材的延续性,在本书中使用第一种方式命名烷基。
失去不同数目的氢原子,可以形成游离价键数不同的取代基。脱去两个氢原子后所形成的二价游离价键结构,通称为亚基。当与同一个母体上同一个原子相连时,称为亚基,而与两个原子相连时,则称为叉基。亚基的英文名称构成与前述相似,有两种构成方法。命名时,中文在烷烃命名后加叉基、亚基表示,英文则分别使用后缀﹣diyl,-ylidene表示。
烷烃的系统命名法
(a)从直链烷烃的构造式中选取最长的连续碳链作为主链,支链作为取代基。(b)将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号,(c)命名时,将取代基的名称写在主链名称之前,用主链上碳原子的编号表示取代基所在的位次,写在取代基名称之前,两者之间用短横线"-"相连。当含有几个不同的取代基时,按取代基的英文命名首字母顺序排列,并尽可能给予靠前的取代基以小的编号。当含有多个相同的取代基时,相同的取代基合并,用二、三、四等表示其数目,并逐个标明其所在位次,位次号之间用逗号","分开;英文名称中使用di-,tri-,tetra﹣表示,但这些字根不参与取代基的排序;英文名称中,斜体字部分不参与排序,如叔丁基(tert-butyl)从字母b开始排序。
当取代基的名称中含有位次的编号时,为与主链编号区别,把支链的全名放在括号中,括号内英文非斜体字部分首字母参与排序,包括表示取代基数目的di-,tri-,tetra-等的首字母。括号可依次使用圆括号、方括号和大括号表示不同层次。
环烷烃的命名
环烷烃属于脂环烃。脂环烃根据分子中所含碳环数目的不同,分为单环、二环和多环脂环烃。
上述多环脂环烃分别于1973年,19年,1966年和1941年被人工合成出来。其中,三棱烧稳定性最差,在90℃时半衰期为11h,主要异构化产物为苯。
(1)单环环烷烃 单环环烷烃的命名与烷烃相似,根据成环碳原子个数称为"环某烷",将环上的支链作为取代基,其名称放在"环某烷"之前,英文名称则使用cyclo﹣作为前缀加在烷烃名称之前。如果环上不止一个取代基时,需要对成环碳原子进行编号。编号时,应遵循"最低位次"原则使取代基的编号尽可能;如果仍有选择,应按照取代基英文命名字母次序给靠前的取代基以较小的编号。
当环上的碳原子数比与环相连碳链的碳原子数少时,或碳链连有多个环时,通常以开链烷烃为母体,环作为取代基来命名。
(2)二环环烷烃 二环环烷烃因两个环连接方式不同,又分为联环、螺环和桥环三种类型。两个环彼此以单键相连的,称为联环烷烃;两个环共用一个碳原子的,称为螺环烷烃;两个环共用两个或两个以上碳原子的,称为桥环烷烃。
最常见的联环烷烃是由两个相同环组成的,称为"联二环某烷",如联二环已烷;如果两个环不相同,通常将较大的环作为母体,较小的环作为取代基,如环丙基环戊烷。
(a)桥环烷烃。二环桥环烷烃命名时,以"二环"作词头,按成环碳原子的总数称为"某烷"。两环连接处的碳原子作为桥头碳原子,其他碳原子作为桥碳原子。各桥的碳原子数由大到小分别用数字表示,并用下角圆点分开,放在方括号中,然后将此方括号放在"二环"和"某烷"之间。环上的编号是从一个桥头碳原子开始,沿最长的桥到另一个桥头碳原子,再沿次长的桥编回到开始的桥头碳原子,最短桥上的碳原子从编号低的桥头碳原子一侧开始最后编号。若环上连有支链时,支链作为取代基,将取代基的位次和名称放在"二环"之前即得全名。
(b)螺环烷烃。二环螺环烷烃命名时,两个碳环共用的碳原子称为螺原子,以"螺"作为词头,按成环的碳原子总数称为"某烷"。在方括号中用阿拉伯数字分别标明除螺原子外每个碳环所含的碳原子数,但顺序是由小环到大环,数字之间用下角圆点分开。环上编号的顺序是由较小环中与螺原子相邻的碳原子开始,沿小环编号,然后通过螺原子到较大的环。若环上有支链时,支链的命名与桥环烷烃中的支链命名相同。
3.烷烃和环烷烃的结构
西格玛 键的形成及其特性·
环烷烃的结构与环的稳定性·
从表2-3中可以看出,由环丙烷到环戊烷,随着环的增大,每个甲叉基单元的摩尔燃烧热依次降低,环越小则每个甲叉基单元的摩尔燃烧热越大。这说明在小环化合物中,环越小能量越高,越不稳定。由环已烷开始,与烷烃相似,甲叉基单元的摩尔燃烧热趋于恒定。这表明环烷烃的稳定性是由其成环碳原子数决定的。其中,小环(三、四元环)与普通环(五到七元环)、中环(八到十一元环)、大环(≥十二元环)环烷烃在结构上是存在明显差别的。 由以上可以看出,在环烷烃分子中,环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,而环己烷最稳定。
价键理论认为,环丙烷环不稳定的原因,是由于成环碳原子的sp* 杂化轨道未能形成最大程度重叠所致。如在丙烷分子中,C-C-C的键角与轨道对称轴之间的夹角(轨道夹角)为109.5°左右。而在环丙烷分子中,三个碳原子在同一平面上形成正三角形,碳原子之间的夹角只能是60。因此,环丙烷分子中两个相邻碳原子以sp'杂化轨道形成C-Co键时,两个轨道对称轴不能在一条直线上,而只能以弯曲的方式重叠,这样形成的。键是弯曲的,称为弯曲键,如图2-5所示。
由于受几何形状的限制,环丁烷和环戊烷仍具有一定的角张力,但比环丙烷小。环己烷分子中的C-C-C键键角是正常键角109.5左右,没有角张力。由七到十二个碳原子组成的环烷烃,虽然保持正常的键角,但由于环上C一H键之间相互重叠而存在着扭转张力,因此也不如环己烷稳定。只有相当大的环才与环已烷一样稳定,如环二十二烷经测定是呈锯齿形存在,成环的碳原子不在同一平面上,C-C-C键键角约为109.5,是无张力环,如图2-6所示。在自然界存在最广泛的脂环化合物是由六元环构成的,其次是五元环。
从环丁烷开始,为了避免相邻C-H键相互重叠而产生扭转张力,组成环的碳原子均不在同一平面上。例如,环丁烷骨架是蝴蝶型结构;环戊烷骨架存在两种不同结构﹣﹣信封型(有四个碳原子共平面)和扭曲型(三个碳原子共平面)。
4.烷烃和环烷烃的构象
乙烷的构象
在乙烷分子中,如果使一个甲基固定,而使另一个甲基绕C-Co键轴旋转,则两个甲基中氢原子的相对位置将不断改变,产生许多不同的空间排列方式,一种排列方式相当于一种构象。由于转动的角度可以无穷小,因此,乙烷分子可以有无穷多的构象。其中,两个碳原子上的氢原子相距最近的构象,即两个甲基相互重叠的构象,称为重叠式构象(eclipsed conformation);另一种是两个碳原子上的氢原子相距最远的构象,即一个甲基上的氢原子处于另一个甲基上的两个氢原子正中间的构象,称为交叉式构象(staggered confor-mation)。重叠式构象和交叉式构象是乙烷分子中两种典型的极限构象,如图2-7所示。像上述乙烷的构象表达式(a)和(b)那样,分子的构象表达式称为构象式。图2-7(a)是乙烷分子构象式的锯架式表示法,(b)是Newman投影式表示法。Newman投影式是从C-Co键的延长线上观察,两个碳原子在投影式中处于重叠位置,用表示距离观察者较近的碳原子及其三个键,在投影式中每个碳原子上的三个键互呈120。
在乙烷的重叠式构象中,两个碳原子上的C-H。键两两相对,C-H键上的。电子对之间距离最近,相互之间的排斥力(扭转张力)最大,因而能量最高,最不稳定。而在交叉式构象中,两个碳原子上的C-H。键两两交错,C-H键上的。电子对之间距离最远,相互之间排斥力(扭转张力)最小,因而能量最低,是最稳定的构象。在一个分子的所有构象中,能量最低即最稳定的构象,称为优势构象。优势构象在各种构象的相互转化中,出现的概率最大。 乙烷的重叠式构象和交叉式构象之间的能量差约为12.6kJ·mol ,此能量差称为能垒。其他构象的能量介于此二者之间,交叉式构象绕C-Ca键旋转60°可以转变成重叠式构象,进步绕C-C。键旋转,又可转变成交叉式构象,但必须给予12.6 kJ.mol的能量克服能垒才能实现。由此可见,通常所说的单键可以自由旋转,也并非完全自由。在室温时,分子所具有的动能已超过此能量,已足够使。键自由旋转。此时乙烷分子是无穷构象迅速转化的动态混合体系,其中以能量较低的交叉式构象为主,但此时要想将其分离出来是不可能的,只有在相当低的温度时,才能得到较稳定的单一交叉式构象的乙烷。 在讨论乙烷的构象时,通常是指交叉式和重叠式这两种极限构象。而在进行构象分析时,通常主要考虑优势构象,如乙烷的交叉式构象。
丁烷的构象
丁烷可以看成乙烷分子中每个碳原子上各有一个氢原子被甲基取代的化合物,其构象更为复杂,现主要讨论绕C2和C3之间的。键键轴旋转所形成的六种极限构象(见图2-9),下面给出四种能量不等的极限构象的名称。在图2-9中,能量最低最稳定的构象是对位交叉式构象,其中。键电子对之间的扭转张力最小,而且两个体积较大的甲基相距最远,非键张力(非键合原子或基团之间所产生的排斥力)也最小;其次是邻位交叉式构象,能量较低;再次为部分重叠式构象,能量较高;全重叠式构象则是能量最高最不稳定的构象,因为在全重叠式构象中,不仅存在扭转张力,而且两个体积较大的甲基相距最近,非键张力也最大。但这些构象之间的能量差并不很大,它们在室温下仍可以绕。键旋转而相互转化,达到动态平衡,大多以稳定的对位交叉式构象存在,其次是较稳定的邻位交叉式构象,而较不稳定的部分重叠式构象和最不稳定的全重叠式构象在平衡中的含量则很少。
像烷烃分子那样,由于绕单键旋转而产生的异构体,称为构象异构体。由于构象异构体只是原子在空间的排列不同,因此与构型异构体都属于立体异构。 构型和构象是有区别的,异构体之间能够通过绕单键旋转快速转化的,属于构象异构,而异构体之间不能相互转化的,属于构型异构。但是,二者之间又没有截然的界线,温度降低,单键自由旋转受阻,某些构象异构体(如某些含有手性轴的联苯型化合物,见第六章6.7.2)可能变成构型异构体。
环已烷的构象
环己烷的六个成环碳原子不共平面,C-C-C键键角约为109.5,是无张力环。椅型构象和船型构象是环己烷的两种极限构象。通过键角的扭动和绕。键的旋转,椅型构象和船型构象可以相互转变,如图2-12所示。 椅型构象和船型构象都保持了正常键角,不存在角张力,但从Newman投影式[见图2-12(b)]中可以看出,椅型构象中所有相邻两个碳原子的碳氢键均处于邻位交叉式位置。而在船型构象中,C2与C3之间和C5与C6之间(即船底)的碳氢键则处于全重叠式位置,从而存在扭转张力;另外,在船型构象中C1和C4两个向内上侧伸展的碳氢键相距较近[0.18 nm,见图2-12(a)],两个氢原子的距离小于其van der Waals半径之和(0.24 nm),因此产生排斥力,即非键张力。由于这两种张力的存在,船型构象的能量比椅型构象的能量高约30kJ·mol '。因此椅型构象是环己烷的优势构象,在平衡体系中环已烷主要以椅型构象存在。
进一步考察环已烷的椅型构象,可以把环上的六个碳原子看作是在C1,C3,C5和C2,C4,C6构成的两个相互平行的平面上。这样环己烷中的十二个碳氢键可以分为两种类型。其中,六个是垂直于这两个平面的,称为直立键或称 a 键(axial bonds),三个向上,另三个向下,交替排列。另外的六个碳氢键则向外斜伸,称为平伏键或称e键(equatorial bonds),也是三个向上斜伸,三个向下斜伸,与平面约呈19。每个碳原子上具有一个a 键,一个e键,如a键向上,则e键向下斜,在环中上下交替排列,如图2-13所示。
取代环已烷的构象
环己烷的一取代物采取椅型构象时,取代基 R 可以处于 e 键上,也可以处于 a 键上,从而出现两种可能的构象,如图2-15所示。当 R 在 a 键时, R 与相邻碳原子的碳架[图2-15( a )蓝色的键]处于邻位交叉式位置,即两个较大基团距离较近。这时, R 与C3和C5位 a 键上的氢原子H3,H5相距较近,因为 R 的 van der Waals 半径比氢原子大,因此, R 与H3,H5之间产生非键张力。结果使得 R 在 a 键上的构象能量较高而较不稳定。当 R 连在 e 键时, R 与相邻碳原子所连的碳架[图2-15( b )蓝色的键]处于对位交叉式位置,即两个较大基团距离最远。这时,处于 e 键上的 R 与H3,H5之间不存在非键张力。因此,取代基连在 e 键上的构象是比较稳定的构象。
环己烷的一元取代物,一般取代基倾向于连在碳环的 e 键上。例如,甲基环已烷95%是甲基处于 e 键的构象。取代基越大,其处于 e 键上的构象概率就越大。例如,叔丁基环已烷99.99%是叔丁基处于 e 键的构象。 这是因为取代基越大,处于 e 键和 a 键构象的势能差(构象能)越大。如果环上连有两个不同的取代基时,一般规律是大的取代基(如叔丁基)优先处于 e 键。多取代的环已烷,则是取代基处于 e 键最多的一般是最稳定的构象。这些规律可用于研究有机化合物的精细结构、有机化学反应机理及有机反应的取向等。
5.烷烃和环烷烃的物理性质
通常单一纯净的有机化合物,其物理性质在一定条件下是固定不变的,测定得到的这些固定数值称为物理常数,它们是特定的化合物在一定条件下所固有的标志。通过物理常数的测定,通常可以鉴定有机化合物及其纯度。利用有机化合物不同的物理性质,也可以进行混合物的分离和有机化合物的纯化。烷烃和环烷烃都是无色的,具有一定气味。它们的物理性质具有一定规律。例如,直链烧烃和无取代基的环烷烃,其熔点、沸点和相对密度随着碳原子数的增加而有规律地升高。其中,环烷烃的熔点、沸点和相对密度比相同碳原子数的烷烃高,这主要是因为环烷烃具有较大的刚性和对称性,使得分子之间的作用力变强。一些直链烷烃和环烷烃的物理常数列于表2-4中。
沸点
直链烷烃的沸点(bp)一般随相对分子质量的增加而升高,如表2-4所示,因为沸点是与分子间的作用力﹣van der Waals力﹣﹣有关的。烷烃是非极性或弱极性分子,分子间van der Waals力全部或主要来源于色散力。色散力的大小与分子中原子的数目和大小有关,烷烃分子中碳原子数增多,则色散力增大,因此,分子间 van der Waals 力增大,沸点随之而升高。一般在常温常压下,四个碳原子以下的直链烧烃是气体,由戊烷开始是液体,大于十七个碳原子的烷烃是固体。 在同系列中,虽然相邻两个烧烃的组成都相差一个CH2,但其沸点差值并不相等,低级烷烃的差值较大,随着相对分子质量的增加相邻两个烷烃的沸点差值逐渐减小。如甲烷与乙烷的沸点相差72.9℃,而十一烷与十二烷的沸点只相差20.4℃。从相对分子质量分析,乙烷的相对分子质量是30,甲烷的相对分子质量是16,虽然只相差一个CH2,但乙烷的相对分子质量比甲烷大87%。而十二烷的相对分子质量(170)仅比十一烷的相对分子质量(156)大9%。可见虽然同样是相差一个CH2,但对整个分子的影响却不一样,这种影响当然也反映在它们的沸点变化上。
此外,在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应的沸点越低。这是因为烷烃的支链增多时,分子之间彼此不易充分靠近,使得分子之间相距较远,而色散只有在很近的距离内才有效,随着距离的增加而很快地减弱,从而分子间van der Waals力减小,沸点相应降低。
熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烧烃的熔点变化也是随着相对分子质量的增减而相应增减,如表2-4所示。但因在晶体中,分子间的作用力不仅取决于分子的大小,而且与分子的对称性有关,对称性高的烷烃在晶格中排列比较紧密,熔点相对高些。一般偶数碳链具有较高的对称性,因此,含偶数碳原子烷烃的熔点通常比含奇数碳原子烷烃的熔点升高较多,构成相应的两条熔点曲线,偶数居上,奇数在下,如图2-17所示。
对于碳原子数相同烧烃的不同异构体,对称性较好的异构体具有较高的熔点。
相对密度
烷烃的相对密度都小于1。相对密度变化的规律也是随着相对分子质量的增加逐渐增大,如表2-4所示。这也是与分子间van der Waals力有关的,分子间的作用力增大,则分子间的距相应减小,所以相对密度必然增大。
溶解度
烷烃在水中的溶解度很小,易溶于有机溶剂。溶解度与溶质及溶剂的结构有关。结构相似的化合物,它们分子间的作用力也相近,因此彼此互溶,通常称为"相似互溶"规则。例如,离子型或强极性的化合物能溶于强极性的溶剂如水中,而难溶于非极性的溶剂如汽油中。反之,非极性或弱极性化合物烷烃则易溶于非极性溶剂汽油而难溶于强极性溶剂水中。溶解度也是有机化合物重要的物理常数。
折射率
折射率的大小与有机化合物的结构有关。在一定波长的光源和一定的温度条件下测得的折射率,对特定的化合物是一个常数,是化合物所固有的特性。一些直链烷烃的折射率如表2-4所示。
6.烷和环烷烃的化学性质
有机化合物的化学性质取决于其分子结构。烷烃和环烷烃(环丙烷和环丁烷除外)都是以能量较高的。键相连,键比较牢固,而且C一Ho键的极性又很小,因此烷烃和环烷烃是比较稳定的化合物,一般在常温下与强酸、强碱、强氧化剂、强还原剂都不起作用。由于它们的相对稳定性,许多烷烃和环已烷常被用作溶剂。但反应的活性是相对的,在一定条件下,烷烃和环烷烃也显示一定的反应性能。
自由基取代反应
化合物分子中的原子或基团被其他原子或基团所取代的反应,称为取代反应。其中,通过自由基取代分子中氢原子的反应,称为自由基取代反应。
(1)卤化反应 在光照、加热或催化剂的作用下,烷烃和环烷烃(小环环烷烃除外)分子中的氢原子被卤原子取代,生成烃的卤素衍生物和卤化氢。
像烷烃和环烷烃这样,分子中的氢原子被卤原子取代的反应,称为卤化反应。 在烷烃和环烷烃中,只有甲烷、乙烷等少数烷烃和无取代基的环烷烃分子中的氢原子是等同的,经卤化反应可以得到单一的一卤代衍生物,而其他烷烃和环烷烃的卤化反应容易得到混合产物。因此在工业上只有少数烷烃的一卤化反应具有实用价值。
(2)卤化反应机理 反应机理是化学反应所经历的途径或过程,亦称反应历程。有机化合物的反应比较复杂,由反应物到产物常常不只是简单的一步反应,也不只有一种途径,因此只有了解了反应机理,才能认清反应的本质,掌握反应的规律,从而达到控制和利用反应的目的。所以反应机理的研究是有机化学理论的重要组成部分。但反应机理是根据大量的实验事实做出的理论推测,是一种假说,有些是肯定的、可靠的,有些则尚不成熟、尚未获得充分论据、尚需根据新的实验结果改进和补充,而且目前并不是所有反应都能提出明确的反应机理。
生成的氯原子带有未成对的电子,是非常活泼的,遇到甲烷可以夺取其中的氢原子而生成氯化氢和另一个带有未成对电子的甲基自由基CH2CI·和CH3都带有未成对的电子,称为自由基。
甲基自由基也非常活泼,可以再与氯分子作用生成一氯甲烷,同时又生成一个新的氯自由基,这样新生成的氯自由基又可以重复②、③两个基元反应。
④、⑤和⑥为链终止反应。
上述反应的开始,是在一定能量的引发下首先产生自由基,这是一步慢步骤,是反应速率的控制步骤。而反应一经引发出自由基,很快就可以连续不断地进行下去,这样的反应一般称为连锁反应或链反应。①为链反应的引发阶段,②和③为链反应的增长阶段。然而链反应并不是无限连续的,尽管自由基的浓度很低,相互之间碰撞的概率很低,但不是绝对不会发生碰撞。自由基之间一旦发生碰撞,链反应就终止了。例如:
一般讲,链反应分为链引发、链增长和链终止三个阶段。但反应过程是比较复杂的。例如,在链增长阶段,新生成的氯原子也可以与刚生成的一氯甲烷作用而逐步生成二氯甲烷、三氯甲烷和四氯化碳等,主要生成哪种化合物则取决于反应物与试剂的比例、反应的条件和能量等诸多因素。
因此,甲烷的氯化反应所得产物为四种氯甲烷的混合物,由于四者沸点不同,可以通过精馏分离。当然,根据市场需求情况,也可以控制条件使其中一种产物为主。例如,工业上在400~450℃采用热氯化的方法,调节甲烷与氯的摩尔比为10:1,主要产物为一氯甲烷;甲烷与氯的摩尔比为0.263:1时,主要生成四氯化碳。
(3)卤化反应的取向与自由基的稳定性 除甲烷、乙烷等少数烷烃和无取代基的环烧烃外,其他烧烃和环烷烃因结构不同,氢原子所处的位置不同,卤化反应取代的位置各异,即取向不同,同时卤化反应进行的难易程度也不相同。
子主题 1
子主题 2
(4)反应活性与选择性在烷烃和环烷烃的卤化反应中,不同卤素的活性是不同的。
子主题 1
氧化反应
异构化反应
化合物从一种异构体转变成另一种异构体的反应,称为异构化反应。在适当条件下,如在催化剂的作用下和/或加热等,多数烷烃和环烷烃均可发生异构化反应。例如:
异构化反应是可逆的,反应受热力学平衡控制。 直链烷烃异构化为带支链的烷烃,可以提高汽油的辛烷值。环烷烃的异构化包括侧链异构、烷基位置异构和环的异构(环的扩大或缩小)。一些环烷烃经异构化和脱氢可以转变为芳烃,这是以石油为原料生产芳烃时所发生的一些反应。因此,烷烃和环烷烃的异构化反应,在石油工业中占有重要地位。
裂化反应
烷烃和环烷烃在没有氧气存在下进行的热分解反应叫裂化反应。裂化反应是个复杂的过程,其产物为许多化合物的混合物。而且烷烃和环烷烃分子中所含碳原子数越多,产物也越复杂,反应条件不同产物也相应不同。但从主要反应的实质上看,无非是C-C键和C-H键断裂分解的反应。由于C-C键的键能(347 kJ·mol-')小于C-H键的键能(414 kJ·mol-'),一般C-C键较C-H键更容易断裂。烷烃的裂化主要是由较长碳链的烷烃分解为较短碳链的烷烃、烯烃和氢气,但同时也有异构化、环化(转变为脂环烃)、芳构化(转变为芳香烃)、缩合和聚合(由较小分子转变为较大分子的烃)等反应伴随发生,因此,产物就更为复杂。裂化反应是石油加工过程中的一个重要反应,通过把高沸点馏分裂化为相对分子质量小的低沸点馏分的办法,提高汽油、柴油等的产量和质量,并可从石油裂化气中得到更多相对分子质量较小的烯烃等化工原料。 环烷烃的裂化主要是发生开环分解生成小分子的不饱和烃,以及脱氢生成环烯烃和芳烃等。 裂化反应可以在不加催化剂的条件下加热裂化,称为热裂化。热裂化一般要求较高的裂化温度(500~700℃),而且要求一定压力。也可在催化剂(如硅酸铝)的作用下进行裂化,称为催化裂化。催化裂化要求裂化温度较低(450~500℃),而且在常压下即可进行。在炼油生产中,催化裂化生产的汽油,在质量和产率方面均优于热裂化。 拓展:裂化 反应机理 工业上为了得到更多的乙烯、丙烯、丁二烯、乙块等基本化工原料,必须把石油在更高的温度下(高于700℃)进行深度裂化,这样的深度裂化在石油化学工业中称为裂解。裂解和裂化从有机化学上讲是同一类反应,但在石油化学工业上是有特殊意义的,裂解的主要目的是为了获得低级烯烃等化工原料,而不是简单地只为了提高油品的质量和产量。
小环环烷烃的加成反应
子主题 1
7.烷烃和环烷烃的主要来源
烷烃和环烷烃主要来自石油。一般认为,石油是古代的动植物体经细菌、地热、压力及其他无机物的催化作用而生成的物质。虽然因产地不同而成分各异,但其主要成分是各种烃类(开链烷烃、环烷烃和芳烃等)的复杂混合物。由油田得到的原油通常是深褐色的黏稠液体,根据不同的需要经分馏而得到各种不同的馏分。石油的几种主要馏分的大致分馏区间如表2-7所示。石油中所含的烷烃是甲烷以上的直链和支链烷烃,环烷烃则是含五元环和六元环的环烷烃,如环已烷、甲基环已烷、甲基环戊烷和1,2﹣二甲基环戊烷等。天然气也广泛存在于自然界,其主要成分为低级(相对分子质量较小)烷烃的混合物,通常含75%甲烷,15%乙烷,5%丙烷,其余则为较高级(相对分子质量较大)的烷烃。天然气可用作化工原料,也可直接作为燃料。 从石油中获得的烷烃和环烷烃均为混合物,分离成纯净的单一物质十分困难。纯净的烷烃或环烷烃通常需要采用合成方法来制备。
相关思维导图模板

树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 光和影 在线思维导图免费制作,点击“编辑”按钮,可对 光和影 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2f4c9606f70a3f8d98ec4d65695dc3d1









 上海工商
上海工商