电解质溶液思维脑图思维导图

概述,解离平衡,酸碱性等内容讲解
树图思维导图提供 电解质溶液思维脑图 在线思维导图免费制作,点击“编辑”按钮,可对 电解质溶液思维脑图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:353d4fed4354c5233aaa627f1464408d
思维导图大纲
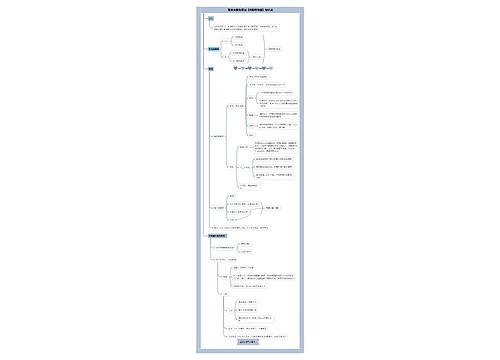
第五章 电解质溶液思维导图模板大纲
概述
电解质:在水溶液中或熔融状态能够导电的化合物。 例如:酸、碱、盐等。
非电解质:在水溶液中或熔融状态都不能导电的化合物。 例如:乙醇、蔗糖等。
第一节 弱电解质的解离平衡
一、强电解质和弱电解质
强电解质:在水溶液里能全部解离成阴、阳离子的电解质。例如:强酸、强碱和绝大多数无机盐。
弱电解质:在水溶液中只有少部分解离成阴、阳离子,大部分仍以分子状态存在的化合物。例如:弱酸、弱碱和少数盐类。
二、弱电解质的解离平衡
解离平衡:在一定条件下,当弱电解质的分子解离成离子和离子重新结合成电解质分子的速度相等时。
解离平衡常数:在一定温度下,弱电解质达到解离平衡状态时,溶液中已解离的各离子浓度幂的乘积与未解离的电解质分子浓度之比为一常数。
解离平衡移动:由于条件(温度 、浓度等)的改变,弱电解质由原来的解离平衡达到新的解离平衡的过程
解离度:已解离的分子数/分子总数
三、同离子效应
在弱电解质溶液中,加入与该弱电解质具有相同离子的强电解质,导致弱电解质的解离度减小的现象 。
第二节 溶液的酸碱性
一、水的解离
水是极弱的电解质,能解离出极少量的H+和OH-
二、溶液的酸碱性和pH
中性溶液 [H+] =[OH-]=10-7 mol/L pH=7 酸性溶液 [H+] >10-7 mol/L >[OH-] pH<7 碱性溶液 [H+] < 10-7 mol/L < [OH-] pH>7
把氢离子浓度的负对数称为pH
三、pH在医学上的应用
正常人血液的pH值在7.35~7.45之间, pH值小于7.35时称为酸中毒, pH值大于7.45时称为碱中毒。
四、酸碱指示剂
酸碱指示剂法和混合指示剂法
第三节 盐溶液的酸碱性
盐的水解的主要类型
强碱弱酸盐水解呈碱性
强酸弱碱盐水解呈酸性
弱酸弱碱盐水解复杂
强酸强碱盐不水解
盐水水解在医学上的应用
酸中毒:碳酸氢钠或乳酸钠
碱中毒:氯化铵
第四节 缓冲溶液
酸碱质子理论
酸:能给出质子H+的物质
碱:能接受质子H+的物质
两性物质:既能接受质子H+又能给出质子H+的物质
注意: 质子理论中无 盐 的概念 , 共轭酸碱对之间仅相差一个质子(H+)。
缓冲作用和缓冲溶液
缓冲作用:能对抗外来少量强酸、强碱或稍加稀释而保持溶液pH值基本不变的作用
缓冲溶液:具有缓冲作用的溶液
缓冲溶液的三大功能:抗酸、抗碱、抗稀释
缓冲溶液的组成 抗酸和抗碱成分
弱酸及其对应的盐HAc-NaAc
弱碱及其对应的盐NH3-NH4Cl
多元酸的酸式盐及其对应的次级盐NaH2PO4-NaHPO4
缓冲溶液在医学上的应用
碳酸和碳酸氢盐缓冲对在血液中浓度最高,缓冲能力最大,对维持血液正常的pH起着决定性作用.
相关思维导图模板

树图思维导图提供 1107文家市玉萍思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 1107文家市玉萍思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:ed943ef641f6dc874860eb6095857ed6

树图思维导图提供 种子思维脑图 在线思维导图免费制作,点击“编辑”按钮,可对 种子思维脑图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:86f8307a40ea24607c6c79354e09377f











 上海工商
上海工商