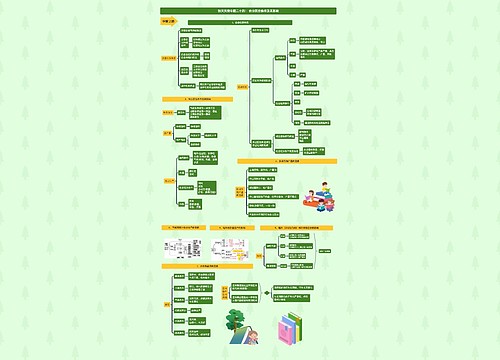
高中化学必修一第三章 金属及其化合物思维导图
高中化学必修一第三章思维导图
树图思维导图提供 高中化学必修一第三章 金属及其化合物 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学必修一第三章 金属及其化合物 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7d5524b9d47d0690b5b587f34376039a
思维导图大纲
高中化学必修一 第三章 金属及其化合物思维导图模板大纲
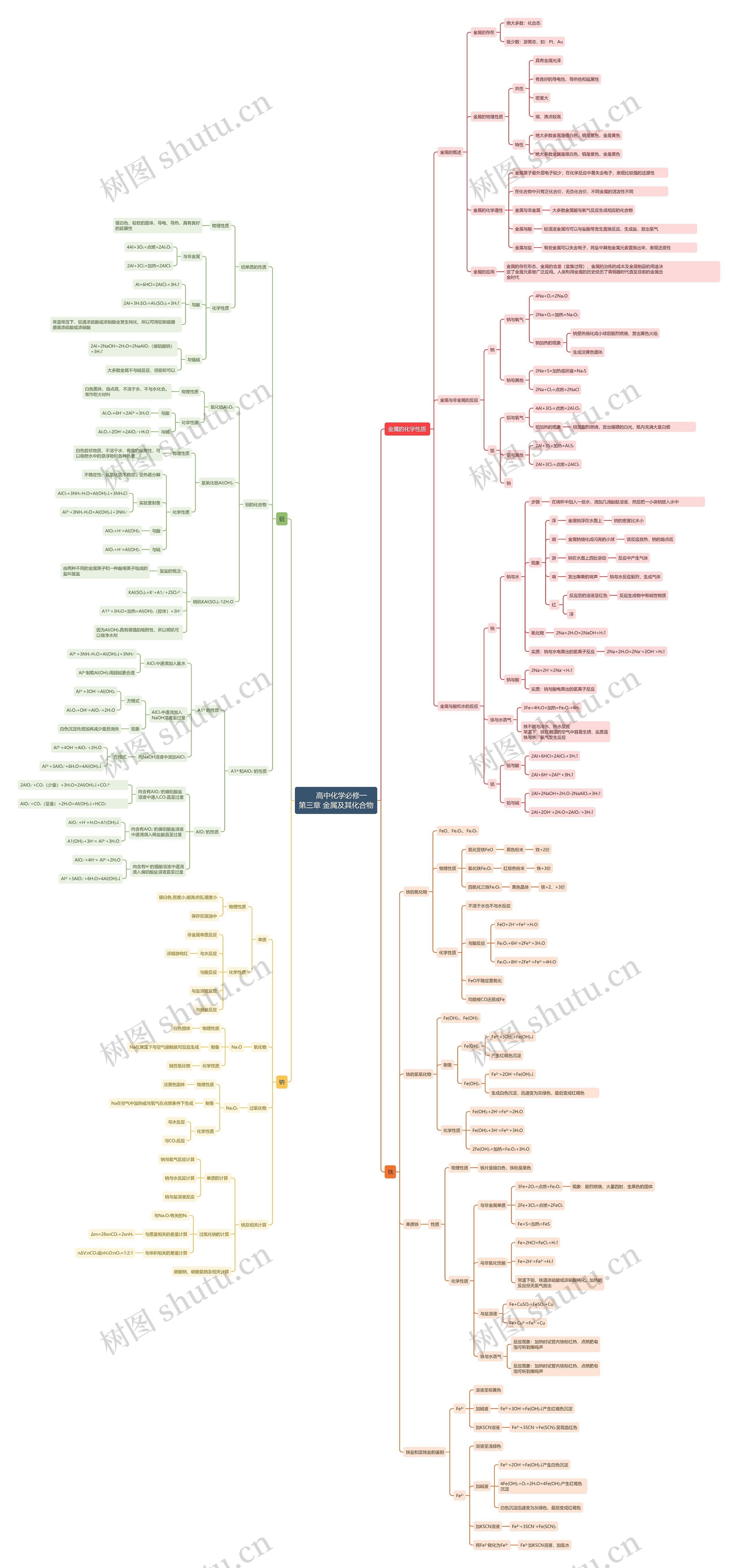
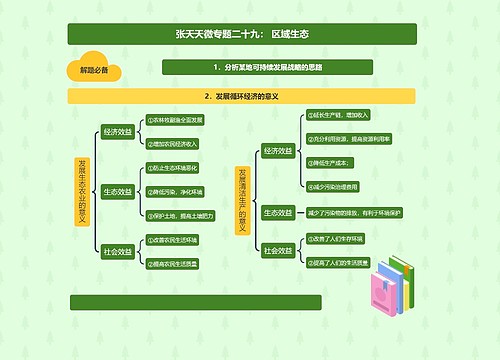
金属的化学性质
金属的概述
金属的存在
绝大多数:化合态
极少数:游离态,如:Pt、Au
金属的物理性质
共性
具有金属光泽
有良好的导电性、导热性和延展性
密度大
熔、沸点较高
特性
绝大多数金属是银白色,铜是紫色,金是黄色
绝大多数金属是银白色,铜是紫色,金是黄色
金属的化学通性
金属原子最外层电子较少,在化学反应中易失去电子,表现比较强的还原性
在化合物中只有正化合价,无负化合价,不同金属的活泼性不同
金属与非金属
大多数金属能与氧气反应生成相应的化合物
金属与酸
较活泼金属均可以与盐酸等发生置换反应,生成盐,放出氢气
金属与盐
有些金属可以失去电子,将盐中其他金属元素置换出来,表现还原性
金属的应用
金属的存在形态、金属的含量(富集过程)、金属的治炼的成本及金属制品的用途决 定了金属元素被广泛应用。人类利用金属的历史经历了青铜器时代直至目前的金属合 金时代
金属与非金属的反应
钠
钠与氧气
4Na+O₂=2Na₂O
2Na+O₂=加热=Na₂O₂
钠加热的现象
钠受热熔化成小球后剧烈燃烧,发出黄色火焰
生成淡黄色固体
钠与其他
2Na+S=加热或研磨=Na₂S
2Na+Cl₂=点燃=2NaCl
铝
铝与氧气
4Al+3O₂=点燃=2Al₂O₃
铝加热的现象
铝箔剧烈燃烧,发出耀眼的白光,瓶内充满大量白烟
铝与其他
2Al+3S=加热=Al₂S₃
2Al+3Cl₂=点燃=2AlCl₃
钠
金属与酸和水的反应
钠
钠与水
步骤
在烧杯中加入一些水,滴加几滴酚酞溶液,然后把一小块钠放入水中
现象
浮
金属钠浮在水面上
钠的密度比水小
熔
金属钠熔化成闪亮的小球
该反应放热,钠的熔点低
游
钠在水面上四处游动
反应中产生气体
响
发出嘶嘶的响声
钠与水反应剧烈,生成气体
红
反应后的溶液呈红色
反应生成物中有碱性物质
浮
氧化物
2Na+2H₂O=2NaOH+H₂↑
实质:钠与水电离出的氢离子反应
2Na+2H₂O=2Na⁺+2OH⁻+H₂↑
钠与酸
2Na+2H⁺=2Na⁺+H₂↑
实质:钠与酸电离出的氢离子反应
铁与水蒸气
3Fe+4H₂O=加热=Fe₃O₄+4H₂
铁不能与冷水、热水反应 常温下,铁在潮湿的空气中容易生锈,实质是铁与水、氧气发生反应
铝
铝与酸
2Al+6HCl=2AlCl₃+3H₂↑
2Al+6H⁺=2Al³⁺+3H₂↑
铝与碱
2Al+2NaOH+2H₂O-2NaAlO₂+3H₂↑
2Al+2OH⁻+2H₂O=2AlO₂⁻+3H₂↑
铝
铝单质的性质
物理性质
银白色,较软的固体,导电、导热,具有良好的延展性
化学性质
与非金属
4Al+3O₂=点燃=2Al₂O₃
2Al+3Cl₂=加热=2AICl₃
与酸
Al+6HCl=2AICl₃+3H₂↑
2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器 盛装浓硫酸或浓硝酸
与强碱
2Al+2NaOH+2H₂O=2NaAlO₂(偏铝酸钠)+3H₂↑
大多数金属不与碱反应,但铝却可以
铝的化合物
氧化铝Al₂O₃
物理性质
白色固体、熔点高、不溶于水,不与水化合。常作耐火材料
化学性质
与酸
Al₂O₃+6H⁺=2Al³⁺+3H₂O
与碱
Al₂O₃+2OH⁻=2AlO₂⁻+H₂O
氢氧化铝Al(OH)₃
物理性质
白色胶状物质,不溶于水,有强的吸附性,可以吸附水中的悬浮物和各种色素
化学性质
不稳定性:氢氧化铝不稳定,受热易分解
实验室制备
AlCl₃+3NH₃·H₂O=Al(OH)₃↓+3NH₄Cl
Al³⁺+3NH₃·H₂O=Al(OH)₃↓+3NH₄⁺
与酸
AlO₂+H⁺=Al(OH)₃
与碱
AlO₂+H⁺=Al(OH)₃
明矾KAl(SO₄)₂·12H₂O
复盐的概念
由两种不同的金属离子和一种酸根离子组成的盐叫复盐
KAl(SO₄)₂=K⁺+A1₃⁺+2SO₄²⁻
A1³⁺+3H₂O=加热=Al(OH)₃(胶体)+3H⁺
因为Al(OH)₃具有很强的吸附性,所以明矾可以做净水剂
A1³⁺和AlO₂⁻的性质
A1³⁺的性质
AlCl₃中逐滴加入氨水
Al³⁺+3NH₃·H₂O=Al(OH)₃↓+3NH₄⁺
Al³⁺制取Al(OH)₃用弱碱更合适
AlCl₃中逐滴加入 NaOH溶液至过量
方程式
Al³⁺+3OH⁻=Al(OH)₃
Al₂O₃+OH⁻=AlO₂⁻+2H₂O
现象
白色沉淀先增加再减少最后消失
向NaOH溶液中滴加AlCl₃
方程式
Al³⁺+4OH⁻=AlO₂⁻+2H₂O
Al³⁺+3AlO₂⁻+6H₂O=4Al(OH)₃↓
AlO₂⁻的性质
向含有AlO₂⁻的偏铝酸盐 溶液中通入CO₂直至过量
2AlO₂⁻+CO₂(少量)+3H₂O=2Al(OH)₃↓+CO₃²⁻
AlO₂⁻+CO₂(足量)+2H₂O=Al(OH)₃↓+HCO₃⁻
向含有AlO₂⁻的偏铝酸盐溶液 中逐滴滴入稀盐酸直至过量
AlO₂⁻+H⁺+H₂O=A1(OH)₃↓
A1(OH)₃+3H⁺= Al³⁺+3H₂O
向含有H⁺的强酸溶液中逐滴 滴入偏铝酸盐溶液直至过量
AlO₂⁻+4H⁺= Al³⁺+2H₂O
Al³⁺+3AlO₂⁻+6H₂O=4Al(OH)₃↓
铁
铁的氧化物
FeO、Fe₂O₃、Fe₃O₄
物理性质
氧化亚铁FeO
黑色粉末
铁+2价
氧化铁Fe₂O₃
红棕色粉末
铁+3价
四氧化三铁Fe₃O₄
黑色晶体
铁+2、+3价
化学性质
不溶于水也不与水反应
与酸反应
FeO+2H⁺=Fe²⁺+H₂O
Fe₂O₃+6H⁺=2Fe³⁺+3H₂O
Fe₃O₄+8H⁺=2Fe³⁺+Fe²⁺+4H₂O
FeO不稳定易氧化
均能被CO还原成Fe
铁的氢氧化物
Fe(OH)₃、Fe(OH)₂
制备
Fe(OH)₃
Fe³⁺+3OH⁻=Fe(OH)₃↓
产生红褐色沉淀
Fe(OH)₂
Fe²⁺+2OH⁻=Fe(OH)₂↓
生成白色沉淀,迅速变为灰绿色,最后变成红褐色
化学性质
Fe(OH)₂+2H⁺=Fe²⁺+2H₂O
Fe(OH)₃+3H⁺=Fe³⁺+3H₂O
2Fe(OH)₃=加热=Fe₂O₃+3H₂O
单质铁
性质
物理性质
铁片是银白色,铁粉是黑色
化学性质
与非金属单质
3Fe+2O₂=点燃=Fe₃O₄
现象:剧烈燃烧,火星四射,生黑色的固体
2Fe+3Cl₂=点燃=2FeCl₃
Fe+S=加热=FeS
与非氧化性酸
Fe+2HCl=FeCl₂+H₂↑
Fe+2H⁺=Fe²⁺+H₂↑
常温下铝、铁遇浓硫酸或浓硝酸钝化。加热能反应但无氢气放出
与盐溶液
Fe+CuSO₄=FeSO₄+Cu
Fe+Cu²⁺=Fe²⁺+Cu
铁与水蒸气
反应现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声
反应现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声
铁盐和亚铁盐的鉴别
Fe³⁺
溶液呈棕黄色
加碱液
Fe³⁺+3OH⁻=Fe(OH)₃↓产生红褐色沉淀
加KSCN溶液
Fe³⁺+3SCN⁻=Fe(SCN)₃呈现血红色
Fe²⁺
溶液呈浅绿色
加碱液
Fe²⁺+2OH⁻=Fe(OH)₂↓产生白色沉淀
4Fe(OH)₂+O₂+2H₂O=4Fe(OH)₂产生红褐色沉淀
白色沉淀迅速变为灰绿色,最后变成红褐色
加KSCN溶液
Fe³⁺+3SCN⁻=Fe(SCN)₃
将Fe²⁺转化为Fe³⁺
Fe²⁺加KSCN溶液,加氯水
钠
单质
物理性质
银白色,密度小,熔沸点低,硬度小
保存在煤油中
化学性质
非金属单质反应
与水反应
浮熔游响红
与酸反应
与盐溶液反应
与熔盐反应
氧化物
Na₂O
物理性质
白色固体
制备
Na在常温下与空气接触就可反应生成
化学性质
碱性氧化物
过氧化物
Na₂O₂
物理性质
淡黄色固体
制备
Na在空气中加热或与氧气在点燃条件下生成
化学性质
与水反应
与CO₂反应
钠及相关计算
单质的计算
钠与氧气反应计算
钠与水反应计算
钠与盐溶液反应
过氧化钠的计算
与Na₂O₂有关的N₂
与质量相关的差量计算
Δm=28xnCO₂+2xnH₂
与体积相关的差量计算
nΔV:nCO₂或nH₂O:nO₂=1:2:1
碳酸钠、碳酸氢钠及相关计算








 上海工商
上海工商