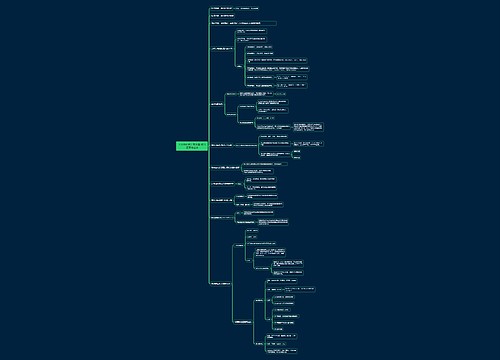
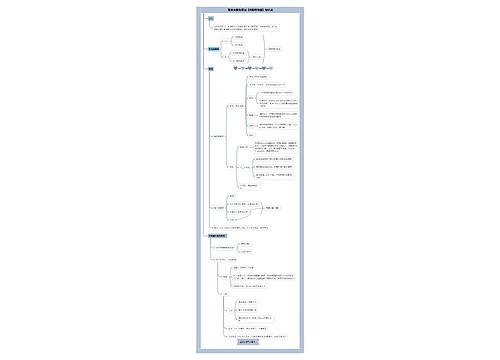
《分析化学》酸碱滴定法思维导图
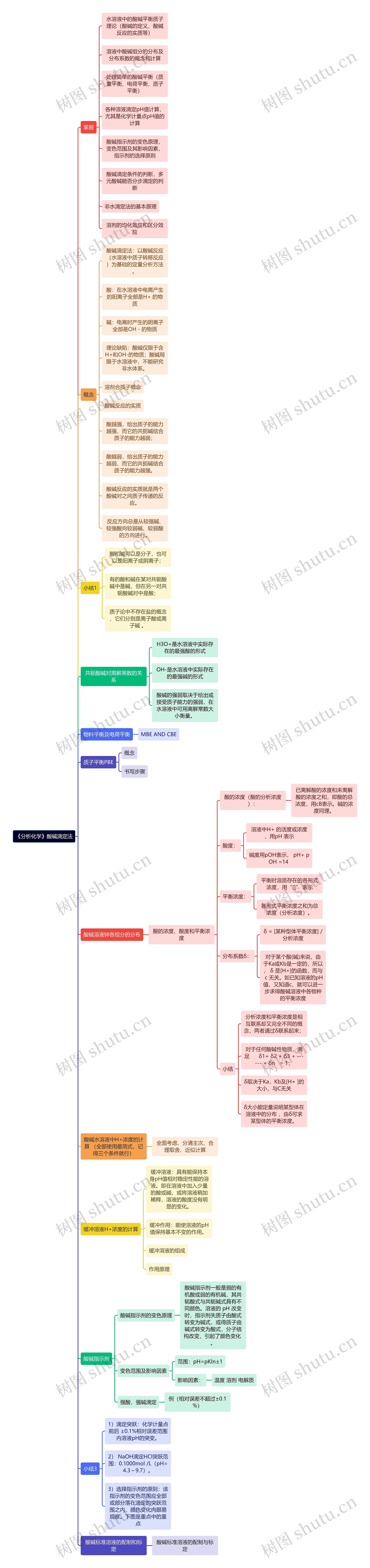
分析化学当中的酸碱滴定法
树图思维导图提供 《分析化学》酸碱滴定法 在线思维导图免费制作,点击“编辑”按钮,可对 《分析化学》酸碱滴定法 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:53cb16e15486f463eed3749fcb8f0899
思维导图大纲
《分析化学》酸碱滴定法思维导图模板大纲
掌握
水溶液中的酸碱平衡质子理论(酸碱的定义、酸碱反应的实质等)
溶液中酸碱组分的分布及分布系数的概念和计算
处理简单的酸碱平衡(质量平衡、电荷平衡、质子平衡)
各种溶液滴定pH值计算,尤其是化学计量点pH值的计算
酸碱指示剂的变色原理,变色范围及其影响因素,指示剂的选择原则
酸碱滴定条件的判断,多元酸碱能否分步滴定的判断
非水滴定法的基本原理
溶剂的均化效应和区分效应
概念
酸碱滴定法:以酸碱反应(水溶液中质子转移反应)为基础的定量分析方法。
酸:在水溶液中电离产生的阳离子全部是H+ 的物质
碱:电离时产生的阴离子全部是OH-的物质
理论缺陷:酸碱仅限于含H+和OH-的物质;酸碱局限于水溶液中,不能研究非水体系。
溶剂合质子概念
酸碱反应的实质
酸越强,给出质子的能力越强,而它的共扼碱结合质子的能力越弱;
酸越弱,给出质子的能力越弱,而它的共扼碱结合质子的能力越强。
酸碱反应的实质就是两个酸碱对之间质子传递的反应。
反应方向总是从较强碱、较强酸向较弱碱、较弱酸的方向进行。
小结1
酸和碱可以是分子,也可以是阳离子或阴离子;
有的酸和碱在某对共轭酸碱中是碱,但在另一对共轭酸碱对中是酸;
质子论中不存在盐的概念,它们分别是离子酸或离子碱 。
共轭酸碱对离解常数的关系
H3O+是水溶液中实际存在的最强酸的形式
OH-是水溶液中实际存在的最强碱的形式
酸碱的强弱取决于给出或接受质子能力的强弱,在水溶液中可用离解常数大小衡量。
物料平衡及电荷平衡
MBE AND CBE
质子平衡PBE
概念
书写步骤
酸碱溶液钟各组分的分布
酸的浓度、酸度和平衡浓度
酸的浓度(酸的分析浓度):
已离解酸的浓度和未离解酸的浓度之和,即酸的总浓度,用cB表示。碱的浓度同理。
酸度:
溶液中H+ 的活度或浓度,用pH 表示
碱度用pOH表示, pH+ pOH =14
平衡浓度:
平衡时溶质存在的各形式浓度,用“[]” 表示
各形式平衡浓度之和为总浓度(分析浓度)。
分布系数δ:
δ = [某种型体平衡浓度] /分析浓度
对于某个酸(碱)来说,由于Ka或Kb是一定的,所以, δ 是[H+]的函数,而与 c 无关。如已知溶液的pH值,又知道c,就可以进一步求得酸碱溶液中各物种的平衡浓度
小结
分析浓度和平衡浓度是相互联系却又完全不同的概念,两者通过δ联系起来;
对于任何酸碱性物质,满足 δ1+ δ2 + δ3 + ------ + δn = 1;
δ取决于Ka,Kb及[H+ ]的大小,与C无关
δ大小能定量说明某型体在溶液中的分布 ,由δ可求某型体的平衡浓度。
酸碱水溶液中H+浓度的计算 (全部使用最简式,记得三个条件就行)
全面考虑、分清主次、合理取舍、近似计算
缓冲溶液H+浓度的计算
缓冲溶液:具有能保持本身pH值相对稳定性能的溶液。即在溶液中加入少量的酸或碱,或将溶液稍加稀释,溶液的酸度没有明显的变化。
缓冲作用:能使溶液的pH值保持基本不变的作用。
缓冲溶液的组成
作用原理
酸碱指示剂
酸碱指示剂的变色原理
酸碱指示剂一般是弱的有机酸或弱的有机碱,其共轭酸式与共轭碱式具有不同颜色。溶液的 pH 改变时,指示剂失质子由酸式转变为碱式,或得质子由碱式转变为酸式,分子结构改变,引起了颜色变化 。
变色范围及影响因素
范围:pH=pKIn±1
影响因素:
温度 溶剂 电解质
强酸,强碱滴定
例(相对误差不超过±0.1%)
小结3
1)滴定突跃:化学计量点前后 ±0.1%相对误差范围内溶液pH的突变。
2) NaOH滴定HCl突跃范围:0.1000mol /L(pH=4.3~9.7)。
3)选择指示剂的原则:该指示剂的变色范围应全部或部分落在滴定的突跃范围之内,颜色变化肉眼易观察。下图是重点中的重点
酸碱标准溶液的配制和标定
酸碱标准溶液的配制与标定
相关思维导图模板

树图思维导图提供 第一章分析化学绪论 在线思维导图免费制作,点击“编辑”按钮,可对 第一章分析化学绪论 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:92555932d0210f784c6deee257f51164

树图思维导图提供 分析化学中的误差与数据处理 在线思维导图免费制作,点击“编辑”按钮,可对 分析化学中的误差与数据处理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b29e13a28d897512c91b62dcd68b3e38













 上海工商
上海工商