分析化学沉淀滴定法的思维导图
免费下载
免费使用文件
one 浏览量:52022-11-16 15:24:40
已被使用0次

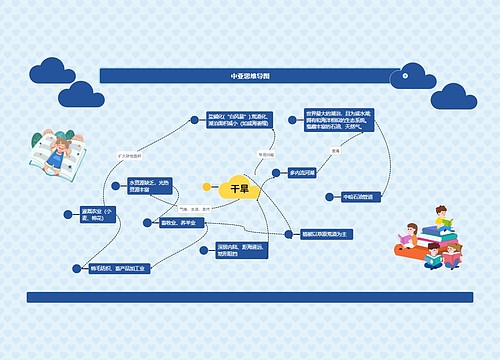
本张思维导图关于沉淀滴定法的主要知识点
树图思维导图提供 分析化学沉淀滴定法的思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 分析化学沉淀滴定法的思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:009cc4dc630fd15ac393221c2055d752
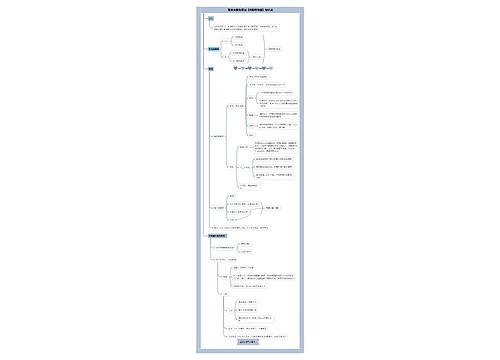
思维导图大纲
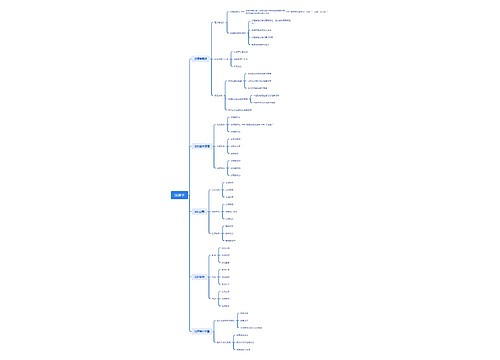
沉淀滴定法思维导图模板大纲
铬酸钾指示剂法
用K2Cr2O4作指示剂,在中性或弱碱性溶液中,用AgNO3标准溶液直接滴定Cl-(或Br-)
分步沉淀的原理
首先是生成AgCl沉淀,随着AgNO3不断加入,溶液中Cl-浓度越来越少,Ag+浓度则相应地增大,砖红色Ag2CrO4沉淀的出现指示滴定终点。
应注意以下几点
(1)必须控制K2Cr2O4的浓度。实验证明,K2Cr2O4浓度以5×10-3mol/L左右为宜。
(2)适宜pH范围是6.5~10.5。
(3)含有能与CrO42-或Ag+发生反应离子均干扰滴定,应预先分离
(4)只能测Cl-、Br-和CN-,不能测定I-和SCN-。
铁铵钒指示剂法
是以KSCN或NH4SCN为滴定剂,终点形成红色FeSCN2+指示终点的方法。
直接滴定法和返滴定法两种
(1)直接滴定法是以NH4SCN(或KSCN)为滴定剂,在HNO3酸性条件下,直接测定Ag+。
(2)返滴定法是在含有卤素离子的HNO3溶液中,加入一定量过量的AgNO3,用NH4SCN标准溶液返滴定过量的AgNO3。用返滴定法测定Cl-时,为防止AgCl沉淀转化,需在用NH4SCN标准溶液滴定前,加入硝基苯等防止AgCl沉淀转化。
吸附指示剂法
以吸附剂指示终点的银量法
为了使终点颜色变化明显,要注意以下几点
(1)沉淀需保持胶体状态。
(2)溶液的酸度必须有利于指示剂的呈色离子存在。
(3)滴定中应当避免强光照射。
(4)胶体颗粒对指示剂的吸附能力应略小于对被测离子的吸附能力。













 上海工商
上海工商