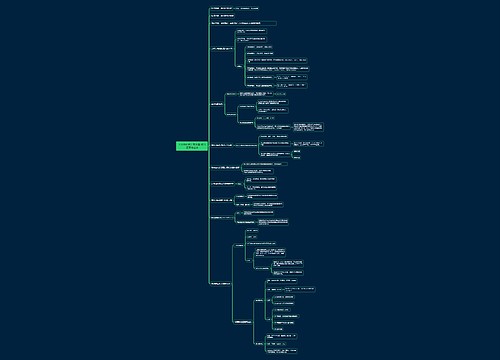
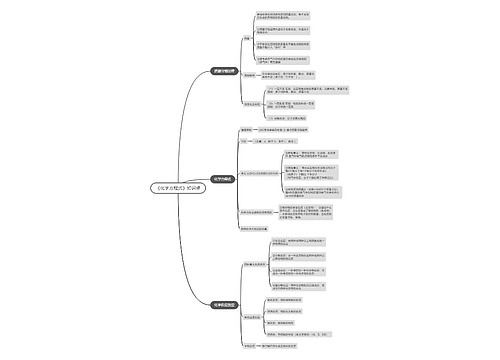
《无机化学》化学理论思维导图
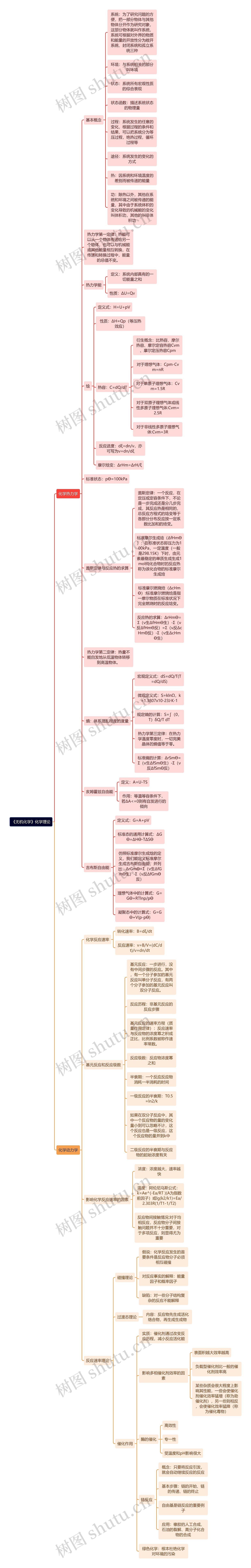
《无机化学》化学理论内容
树图思维导图提供 《无机化学》化学理论 在线思维导图免费制作,点击“编辑”按钮,可对 《无机化学》化学理论 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70b6a5adc12f92abb9972541df5beb7d
思维导图大纲
《无机化学》化学理论思维导图模板大纲
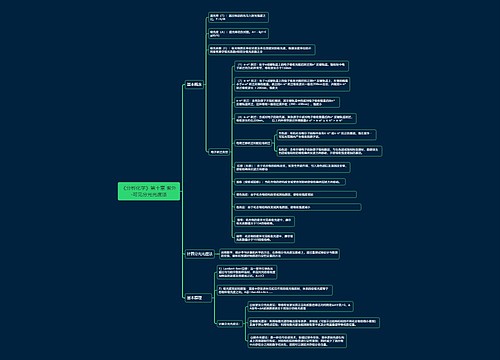
化学热力学
基本概念
系统:为了研究问题的方便,把一部分物体与其他物体分开作为研究对象,这部分物体就叫作系统,系统可根据对外界的物质和能量的开放性分为敞开系统、封闭系统和孤立系统三种
环境:与系统相关的部分叫环境
状态:系统所有宏观性质的综合表现
状态函数:描述系统状态的物理量
过程:系统发生的任意的变化,根据过程的条件和结果,可以把系统分为等压过程,绝热过程,循环过程等
途径:系统发生的变化的方式
热:因系统和环境温度的差别而被传递的能量
功:除热以外,其他在系统和环境之间被传递的能量,其中由于系统体积的变化导致的机械能的变化叫体积功,其他的叫非体积功
热力学第一定律:热能可以从一个物体传递给另一个物体,也可以与机械能或其他能量相互转换,在传递和转换过程中,能量的总值不变。
热力学能
定义:系统内部具有的一切能量之和
性质:ΔU=Qv
焓
定义式:H=U+pV
性质:ΔH=Qp(等压热效应)
热容:C=dQ/dT
衍生概念:比热容、摩尔热容、摩尔定容热容Cvm、摩尔定压热容Cpm
对于理想气体:Cpm-Cvm=nR
对于单原子理想气体:Cvm=1.5R
对于双原子理想气体或线性多原子理想气体:Cvm=2.5R
对于非线性多原子理想气体:Cvm=3R
反应进度:dξ=dn/ν,亦可写为ν=dn/dξ
摩尔焓变:ΔrHm=ΔrH/ξ
标准状态:pϴ=100kPa
盖斯定律与反应热的求算
盖斯定律:一个反应,在定压或定容条件下,不论是一步完成还是分几步完成,其反应热是相同的,总反应方程式的焓变等于各部分分布反应按一定系数比加和的焓变。
标准摩尔生成焓(ΔfHmϴ):在标准状态即压力为100kPa,一定温度(一般是298.15K)下时,由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓
标准摩尔燃烧焓(ΔcHmϴ):标准摩尔燃烧焓是指一摩尔物质在标准状况下完全燃烧时的反应焓变。
反应热的求算:ΔrHmϴ=Σ(ν生ΔfHmϴ生)-Σ(ν反ΔfHmϴ反)=Σ(ν反ΔcHmϴ反)-Σ(ν生ΔcHmϴ生)
热力学第二定律:热量不能自发地从低温物体转移到高温物体。
熵:体系混乱程度的度量
宏观定义式:dS=dQ/T(T=dQ/dS)
微观定义式:S=klnΩ,k=1.3807x10-23J·K-1
规定熵的计算:S=∫(0,T)δQ/T dT
热力学第三定律:在热力学温度零度时,一切完美晶体的熵值等于零。
标准熵的计算:ΔrSmϴ=Σ(ν生ΔfSmϴ生)-Σ(ν反ΔfSmϴ反)
亥姆霍兹自由能
定义:A=U-TS
作用:等温等容条件下,若ΔA<=0则有自发进行的倾向
吉布斯自由能
定义式:G=A+pV
标准态的通用计算式:ΔGϴ=ΔHϴ-TΔSϴ
仿照标准摩尔生成焓的定义,我们能定义标准摩尔生成吉布斯自由能,并列出:ΔrGmϴ=Σ(ν生ΔfGmϴ生)-Σ(ν反ΔfGmϴ反)
理想气体中的计算式:G=Gϴ+RTlnp/pϴ
凝聚态中的计算式:G=Gϴ+V(p-pϴ)
化学动力学
化学反应速率
转化速率:Β=dξ/dt
反应速率:v=Β/V=(dC/dt)/ν=dn/dt
基元反应和反应级数
基元反应:一步进行,没有中间步骤的反应。其中,有一个分子参加的基元反应叫单分子反应,有两个分子参加的基元反应叫双分子反应。
反应历程:非基元反应的反应步骤
基元反应的速率方程(质量作用定律):反应速率与反应物的浓度幂之积成正比,比例系数被称作速率常数。
反应级数:反应物浓度幂之和
半衰期:一个反应反应物消耗一半消耗的时间
一级反应的半衰期:T0.5=ln2/k
如果在双分子反应中,其中一个反应物的量的变化量小到可以忽略不计,这个反应也是一级反应,这个反应物的量并到k中
二级反应的半衰期与反应物的起始浓度有关
影响化学反应速率的因素
浓度:浓度越大,速率越快
温度:阿伦尼乌斯公式: k=Ae^(-Ea/RT )(A为指数前因子)或lg(k2/k1)=Ea/2.303R(1/T1-1/T2)
反应物间接触情况:对于均相反应,反应物分子间接触问题并不十分重要,对于多项反应,则显得尤为重要
反应速率理论
碰撞理论
假说:化学反应发生的首要条件是反应物分子必须相互碰撞
对反应事实的解释:能量因子和概率因子
缺陷:对一些分子结构复杂的反应不能解释
过渡态理论
内容:反应物先生成活化络合物,再生成生成物
催化作用
实质:催化剂通过改变反应历程,减小反应活化能
影响多相催化剂效率的因素
表面积越大效率越高
负载型催化剂比一般的催化剂效率高
某些杂质会很大程度上影响其性能,一些会使催化剂催化效率猛增(称为助催化剂),另一些则相反,会使催化效率猛降(称为催化毒物)
酶的催化
高效性
专一性
受温度和pH影响很大
链反应
概念:只要将反应引发,就会自动继续反应的反应
基本步骤:链的开始、链的传递、链的终止
自由基是链反应的重要例子
应用:橡胶的人工合成、石油的裂解、高分子化合物的合成
绿色化学:根本杜绝化学对环境的污染
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096

树图思维导图提供 辅导员队伍建设 在线思维导图免费制作,点击“编辑”按钮,可对 辅导员队伍建设 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:660abcadc2f7924e5c9f9690c9447d4c







 上海工商
上海工商