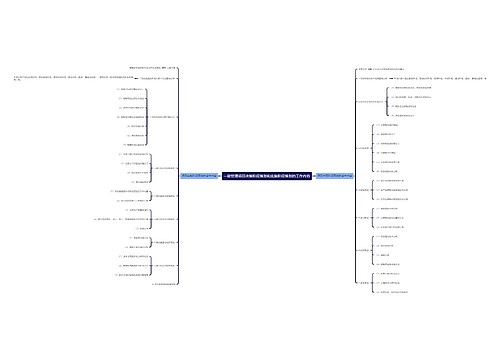
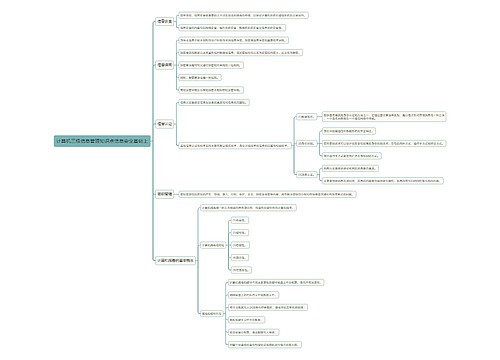
临床试验纸质源文件受控管理专家共识思维导图

研究背景,法规要求,受控管理共识等内容讲解
树图思维导图提供 临床试验纸质源文件受控管理专家共识 在线思维导图免费制作,点击“编辑”按钮,可对 临床试验纸质源文件受控管理专家共识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:73c3c90ac0ad5e6bc12c332ea717f2b9
思维导图大纲
临床试验纸质源文件受控管理专家共识思维导图模板大纲
一、研究背景
纸质源文件仍是临床试验记录的重要方式之一
纸质记录在数据轨迹和溯源等方面固有一些局限:例篡改和替换
二、法规要求
(1)2020.07.01《药物临床试验质量管理规范》
1、源数据应当具有可归因性、易读性、同时性、原始性、准确性、完整性、一致性和持久性
2、源数据的修改应当留痕,不能掩盖初始数据,并记录修改的理由
(2)2020年第74号《药品记录与数据管理要求》
1、记录文件的印制与发放应当根据记录的不同用途与类型,采用与记录重要性相当的受控方法,防止对记录进行替换或篡改
2、原始数据应当直接记载于规定的记录上,不得通过非受控的载体进行暂写或转录
(3)2021年第30号《药品注册核查要点与判定原则(药物临床试验)(试行)》
1、纸质记录(记录本、记录纸)受控管理,表格进行版本控制
2、记录更改保持原有信息清晰可辨,注明修改人姓名、修改日期和理由
三、受控管理共识
(1)根本目的
1、防止记录进行替换货篡改
2、临床试验实施前应明确“必须受控纸质源文件目录”
(2)范围界定
1、主要对象
载有直接或间接指向有效性和安全性评价的数据、主要研究终点指标相关数据的纸质源文件
2、次要对象
载有临床试验操作活动相关的纸质源文件
(3)实施应根据项目特点
1、具体实施时,应根据项目特点,充分考虑可行性(可操作性)
2、不同类别的临床试验,纸质版源文件受控管理有所不同
(1)I期:研究者多为专职人员,受试者多采用集中管理,多数纸质源文件(如给药记录、采血记录、样本处理记录、不良事件记录等)容易实现受控管理
(2)II、III期:研究者多为兼职人员,受试者往往不能做到集中管理,且试验周期较长,应选择关键的纸质源文件进行受控管理
(4)责任划分
责任主体
申办者
基于具体项目制定临床试验受控文件总体要求及目录
(1)哪些纸质版源文件需要受控管理
(2)具体受控管理的程序和操作规范
使用和管理
临床试验机构
组织管理专门部门(机构办公室)负有资料管理和质量促进的责任
督促申办方建立纸质源文件受控管理体系,并基于文件受控管理的法规,制定机构的的纸质源文件受控管理制度及相应标准操作规范
子主题 3
直接负责
研究者
向申办方提供机构现有的纸质源文件受控管理的总体要求,既往使用和管理经验
需要对申办方纸质源文件受控管理规定审核同意
临床试验实施过程中,严格按照已建立的SOP管理纸质源文件
监查
监查员
在临床试验实施过程中,持续审核和确认纸质源文件符合受控管理要求,发现问题时应当及时指出和协助解决,必要时采取纠正和预防措施
(5)发展趋势
电子源数据优势:数据录入、保存、轨迹
数字化手段是解决纸质版源文件受控管理的必然趋势
相关思维导图模板

树图思维导图提供 数智技术在工程设备管理中的应用 在线思维导图免费制作,点击“编辑”按钮,可对 数智技术在工程设备管理中的应用 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9a2de84ad9a9ceebc96385d71be9ebe

树图思维导图提供 数据治理规定 在线思维导图免费制作,点击“编辑”按钮,可对 数据治理规定 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2d62d3c46748939c7f599c53001b9d40




 上海工商
上海工商